��Ŀ����
����Ŀ��25 ��ʱ���ں���Pb2����Sn2����ij��Һ�����������������(Sn)��������Ӧ��Sn(s)��Pb2��(aq) ![]() Sn2��(aq)��Pb(s)����ϵ��c(Pb2��)��c(Sn2��)�仯��ϵ��ͼ��ʾ�������ж���ȷ����( )
Sn2��(aq)��Pb(s)����ϵ��c(Pb2��)��c(Sn2��)�仯��ϵ��ͼ��ʾ�������ж���ȷ����( )
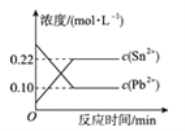
A. ��ƽ����ϵ�м������Ǧ��c(Pb2��)����
B. �����¶ȣ�ƽ����ϵ��c(Pb2��)����˵���÷�Ӧ��H��0
C. 25 ��ʱ���÷�Ӧ��ƽ�ⳣ��K��2.2
D. ��ƽ����ϵ�м�������Sn(NO3)2�����c(Pb2��)��С
���𰸡�C
��������A��ǦΪ���壬����Ũ����Ϊ���������ƽ����ϵ�м������Ǧ��ƽ�ⲻ�ƶ�����c(Pb2��)���䣬��A����B�������¶�c(Pb2��)����˵����Ӧ���淴Ӧ������У�������������ԭ��������Ӧ�����Ƿ��ȷ�Ӧ������H<0����B����C������ƽ�ⳣ���ı���ʽ��K= ![]() =0.22/0.10=2.2����C��ȷ��D����������Sn(NO3)2���壬��Һ��c(Sn2��)����Ӧ���淴Ӧ������У���c(Pb2��)����D����
=0.22/0.10=2.2����C��ȷ��D����������Sn(NO3)2���壬��Һ��c(Sn2��)����Ӧ���淴Ӧ������У���c(Pb2��)����D����

����Ŀ��25��ʱ���������ʵĵ���ƽ�ⳣ�������ʾ��
��ѧʽ | CH3COOH | H2CO3 | HClO |
����ƽ�ⳣ�� | 1��7��10��5molL��1 | K1=4��4��10��7molL��1 K2=5��6��10��11molL��1 | 3��0��10��8 molL��1 |
��ش��������⣺
��1��ͬŨ�ȵ�CH3COO����HCO3����CO32����ClO�����H+��������ǿ������˳��Ϊ_____��
��2��������0��1molL��1��CH3COOH��Һ�ڼ�ˮϡ�����У����б���ʽ������һ����С����_______������ĸ��ţ���ͬ����
A��c��H+�� B��![]() C��c��H+��c��OH����
C��c��H+��c��OH����
D��![]() E��
E�� 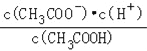
�����߸���Һ�¶ȣ������Ǵ���ӷ���������5�ֱ���ʽ�������������_____��
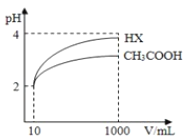
��3�����Ϊ10mL pH=2�Ĵ�����Һ��һԪ��HX��Һ�ֱ��ˮϡ����1000mL��ϡ����pH�仯��ͼ����HX�ĵ���ƽ�ⳣ��_____��������������������������С�����������ƽ�ⳣ����ϡ�ͺ�HX��Һ��ˮ���������c��H+��_____��������������������������С�������������Һ��ˮ���������c��H+����������_____��
��4����֪100��ʱ��ˮ�����ӻ�Ϊ1��10��12�����¶��²��ij��ҺPH=7������Һ��_____�����������������������������ԣ������¶���PH=1��H2SO4��ҺaL��PH=11��NaOH��ҺbL��ϣ������û��ҺPH=2����a��b=_____��
����Ŀ�����ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã��ϳɰ���ҵ�ڹ�������������Ҫ���塣�����ǹ��ںϳɰ����й����⣬��ش�
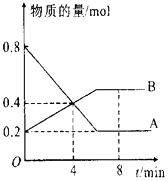
��1������һ�ݻ�Ϊ2 L���ܱ������м���0.2 mol��N2��0.6 mol��H2����һ�������·�����Ӧ�� N2(g) ��3H2(g)![]() 2NH3(g)����H<0������5����ʱ��Ӧ�ﵽƽ�⣬��ʱ���NH3�����ʵ���Ϊ0.2 mol����ǰ5���ӵ�ƽ����Ӧ����v(N2)��________��
2NH3(g)����H<0������5����ʱ��Ӧ�ﵽƽ�⣬��ʱ���NH3�����ʵ���Ϊ0.2 mol����ǰ5���ӵ�ƽ����Ӧ����v(N2)��________��
��2��ƽ�����Ҫ���H2��ת���ʣ����Բ�ȡ�Ĵ�ʩ��________��
A�����˴��� B������������� C�����ͷ�Ӧ��ϵ���¶� D������һ����N2
��3������0.5 L���ܱ������У�һ�����ĵ����������������·�Ӧ��N2(g)��3H2(g)![]() 2NH3(g)����H<0���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ�����ʾ��
2NH3(g)����H<0���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ�����ʾ��
T/�� | 200 | 300 | 400 |
K | K1 | K3 | 0.5 |
������������⣺
���ԱȽ�K1��K2�Ĵ�С��K1________K2(����<������>����������)��
�����и�������Ϊ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������________(�������ĸ)
A��������N2��H2��NH3�����ʵ���Ũ��֮��Ϊ1��3��2
B��v(H2)����3v(H2)��
C��������ѹǿ���ֲ���
D�����������ܶȱ��ֲ���
��400��ʱ����Ӧ2NH3(g)![]() N2(g)��3H2(g)�Ļ�ѧƽ�ⳣ��Ϊ________�������NH3��N2��H2���ʵ����ֱ�Ϊ3 mol��2 mol�� 1 molʱ����÷�Ӧ��v(N2)��________v(N2)��(����<������>����������)��
N2(g)��3H2(g)�Ļ�ѧƽ�ⳣ��Ϊ________�������NH3��N2��H2���ʵ����ֱ�Ϊ3 mol��2 mol�� 1 molʱ����÷�Ӧ��v(N2)��________v(N2)��(����<������>����������)��
��4�����ݻ�ѧ��Ӧ���ʺͻ�ѧƽ�����ۣ���ϵ�ϳɰ�������ʵ�ʣ�����Ϊ����˵������ȷ����________��
A����ѧ��Ӧ�������ۿ�ָ��������һ��ʱ���ڿ����Ʒ
B����������ԭ����ָ������ʹ������ԭ�϶����Ʒ
C��������ʹ������߲�Ʒ���ʵ���Ч����
D����ȷ���û�ѧ��Ӧ���ʺͻ�ѧ��Ӧ�����۶�����������������ۺϾ���Ч��