题目内容
5.某校化学课外小组同学组装了下列仪器,欲经过简单连接,制备中学化学的几种常见气体.
请填写下列表格中的空白处:
| 序号 | 气体 | 装置的连接顺序(用符号表示) | 按要求填试剂 名称 | 实验室制取该气体 的反应方程式 (是离子反应的写离子反应方程式) |
| (1) | CO2 | 制备→收集 | ||
| (2) | NH3 | 制备→收集 →尾气处理 | 若干燥气体可选用的试剂 碱石灰 | |
| (3) | Cl2 | 制备→净化→干燥→收集→尾气处理 | 处理尾气 的试剂 氢氧化钠溶液 | |
| (4) | 制备→净化→收集 C→F→J |
分析 (1)实验室用碳酸钙与稀盐酸反应制备二氧化碳,二者反应生成氯化钙、二氧化碳和水;二氧化碳密度大于空气密度应选择向上排空气法收集;
(2)实验室用加热氯化铵与氢氧化钙的方法制取氨气,二者反应生成氨气、氯化钙和水;氨气为碱性气体,应选择碱性干燥剂,氨气密度小于空气密度,易溶于水,应选择向下排空气法收集;
(3)实验室用二氧化锰与浓盐酸在加热条件下制备氯气,为酸性气体,应选择酸性干燥剂干燥;氯气有毒,氯气可以用氢氧化钠溶液吸收,进行尾气处理,氯气密度大于空气密度,应选择向下排空气法收集;
(4)实验室用在浓硫酸做催化剂脱水剂条件下乙醇脱水制取乙烯,乙烯中含有二氧化硫等杂质,可以用氢氧化钠溶液净化,乙烯密度与空气密度相差不大,不能用排空气法收集,应选择排水法收集.
解答 解:(1)碳酸钙与稀盐酸反应制备二氧化碳,反应离子方程式:CaCO3+2H+=Ca2++CO2↑+H2O,反应物为固体与液体不加热,选择发生装置D,二氧化碳密度大于空气密度应选择向上排空气法收集,选择发生装置H,连接顺序为D→H;
(2)加热氯化铵与氢氧化钙的方法制取氨气,化学方程式:Ca(OH)2+2NH4Cl△_CaCl2+2NH3↑+2H2O,反应物为固体与液体加热,选择发生装置A,氨气为碱性气体,选择碱石灰干燥,氨气密度小于空气密度,易溶于水,应选择向下排空气法收集,连接顺序A→I→L;
(3)二氧化锰与浓盐酸在加热条件下制备氯气,离子方程式:MnO2+4H++2Cl-△_Mn2++Cl2↑+2H2O,选择发生装置B,浓盐酸易挥发,制取的氯气中含有氯化氢、水蒸气杂质,依次通过盛有饱和食盐水、浓硫酸的洗气瓶进行净化,氯气密度大于空气密度,选择向上排空气法收集,氯气有毒,氯气可以用氢氧化钠溶液吸收,可以用进行尾气处理,装置连接顺序为:B→G→E→H→K(或F);
(4)在浓硫酸做催化剂脱水剂条件下乙醇脱水制取乙烯,化学方程式:CH3CH2OH →浓硫酸170℃ CH2=CH2↑+H2O,乙烯中含有二氧化硫等杂质,可以用氢氧化钠溶液净化,乙烯密度与空气密度相差不大,不能用排空气法收集,应选择排水法收集,装置连接顺序为:C→F→J;
故答案为:
| (1) | D→H | CaCO3+2H+=Ca2++CO2↑+H2O | |
| (2) | A→I→L | 碱石灰 (或生石灰等) | Ca(OH)2+2NH4Cl△_CaCl2+2NH3↑+2H2O |
| (3) | B→G→E→H→K(或F) | 氢氧化钠溶液 | MnO2+4H++2Cl-△_Mn2++Cl2↑+2H2O |
| (4)C2H4 | CH3CH2OH→浓硫酸170℃ CH2=CH2↑+H2O |
点评 本题考查了常见气体的制备,涉及制备原理、发生装置、净化装置、收集装置、尾气处理装置的选择,明确气体的性质是解题关键,注意对相关知识的积累,题目难度不大.

 优学名师名题系列答案
优学名师名题系列答案| A. | 分类法是学习和研究化学物质及化学变化的一种科学方法 | |
| B. | 常见的分类方法有交叉分类法和树形分类法 | |
| C. | 对于相同的分类对象,采用的分类标准不同,分类的结果也不同 | |
| D. | 初中的化学知识告诉我们,化学反应可以分为化合反应和分解反应两大类 |
| A. | 当Al3+恰好完全沉淀时,消耗氢氧化钡1.5mol | |
| B. | 当SO42-恰好完全沉淀时,Al3+全部转化为Al(OH)3 | |
| C. | 当向溶液中加入1.5mol氢氧化钡时,反应可用下列离子方程式表示:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ | |
| D. | 反应过程中随加入的氢氧化钡的物质的量不断增大,沉淀的质量不断增大 |
| A. | 稳定性:HAt>HCl | B. | 氧化性:At2>I2 | ||
| C. | At2为分子晶体 | D. | NaAt的水溶液呈碱性 |
| A. | MgO | B. | FeCl2 | C. | CO | D. | H2O |
 已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:
已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:| 醋酸 | 碳酸 | 亚硫酸 |
| Ka=1.75×10-5 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(2)在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性强弱:H2CO3>HSO3->HCO3-.
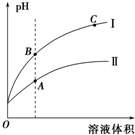
(3)如图表示常温时稀释醋酸、碳酸两种酸的稀溶液时,溶液PH随水量的变化图象中,曲线I表示的酸是CH3COOH(填化学式).
②a、b、c三点中,水的电离程度最大的是C(填字母).

 .
. .
.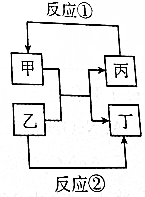 甲、乙、丙、丁四种取值的相互转化关系如图所示(部分反应物、产物及反应条件已略去).已知甲为常见金属(Na、Mg、Al、Fe、Cu)或其氧化物,回答下列问题:
甲、乙、丙、丁四种取值的相互转化关系如图所示(部分反应物、产物及反应条件已略去).已知甲为常见金属(Na、Mg、Al、Fe、Cu)或其氧化物,回答下列问题: