题目内容
Ⅰ.2013年初,雾霾天气多次肆虐天津、北京等地区.其中,燃煤和汽车尾气是造成空气污染的原因之一.
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)
2CO2(g)+N2(g).△H<0
①该反应平衡常数表达式 .
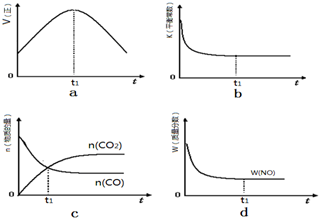
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行t1时刻达到平衡状态的是 (填代号).
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.
煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染.
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol
2NO2(g)?N2O4(g)△H=-56.9kJ/mol
H2O(g)=H2O(l)△H=-44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: .
Ⅱ.A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.
请回答下列问题:
(1)C、D、E三种原子对应的离子半径由大到小的顺序是 (填具体离子符号);A、B、C三种元素按1:7:12的质量比组成的化合物中含有的化学键的类型属于 .
(2)某金属常用于制作易拉罐,该金属制作的废弃易拉罐能与 A、C、D组成的化合物溶液反应,该反应的离子方程式为: .
(3)A、C两元素的单质与烧碱溶液组成燃料电池,其负极反应式为 ,用该电池电解1L1mol/L NaCl溶液,当消耗标准状况下1.12L A2时,所得溶液在常温下的PH= (假设电解过程中溶液的体积不变).
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)
| 催化剂 |
①该反应平衡常数表达式
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行t1时刻达到平衡状态的是

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.
煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染.
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol
2NO2(g)?N2O4(g)△H=-56.9kJ/mol
H2O(g)=H2O(l)△H=-44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:
Ⅱ.A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.
请回答下列问题:
(1)C、D、E三种原子对应的离子半径由大到小的顺序是
(2)某金属常用于制作易拉罐,该金属制作的废弃易拉罐能与 A、C、D组成的化合物溶液反应,该反应的离子方程式为:
(3)A、C两元素的单质与烧碱溶液组成燃料电池,其负极反应式为
考点:化学平衡常数的含义,位置结构性质的相互关系应用,热化学方程式
专题:基本概念与基本理论,元素周期律与元素周期表专题
分析:Ⅰ.(1)①化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值;
②a、到达平衡后正、逆速率相等,不再变化;
b、到达平衡后,温度为定值,平衡常数不变,结合反应热判断随反应进行容器内温度变化,判断温度对化学平衡常数的影响;
c、t1时刻后二氧化碳、NO的物质的量发生变化,最后不再变化;
d、到达平衡后各组分的含量不发生变化;
(2)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式;
Ⅱ.A、B、C、D、E为原子序数依次增大的五种短周期元素,C与B、E在周期表中相邻,且C、E同主族,且C、E同主族,原子序数C大于A、B小于E,则C处于第二周期,E处于第三周期,所以B、C、E在周期表中的位置关系为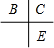 ,A和D最外层电子数相同,则二者处于同族,原子序数D大于C且小于E,则D为第三周期,其中仅含一种金属元素,D应为金属,B、C的最外层电子数之和等于D的原子核外电子数,D的核外电子数为奇数,则D为钠元素或铝元素,若D为钠元素,则A为氢元素,B为氮元素,C为氧元素,E为硫元素,A和C可形成化合物H2O、H2O2,符合题意.若D为铝元素,则A为硼元素,B为氧元素,C为氟元素,E为氯元素,A和C形成化合物,不符合题意,故A为氢元素,B为氮元素,C为氧元素,D为钠元素,E为硫元素;甲为H2O;乙为H2O2.
,A和D最外层电子数相同,则二者处于同族,原子序数D大于C且小于E,则D为第三周期,其中仅含一种金属元素,D应为金属,B、C的最外层电子数之和等于D的原子核外电子数,D的核外电子数为奇数,则D为钠元素或铝元素,若D为钠元素,则A为氢元素,B为氮元素,C为氧元素,E为硫元素,A和C可形成化合物H2O、H2O2,符合题意.若D为铝元素,则A为硼元素,B为氧元素,C为氟元素,E为氯元素,A和C形成化合物,不符合题意,故A为氢元素,B为氮元素,C为氧元素,D为钠元素,E为硫元素;甲为H2O;乙为H2O2.
②a、到达平衡后正、逆速率相等,不再变化;
b、到达平衡后,温度为定值,平衡常数不变,结合反应热判断随反应进行容器内温度变化,判断温度对化学平衡常数的影响;
c、t1时刻后二氧化碳、NO的物质的量发生变化,最后不再变化;
d、到达平衡后各组分的含量不发生变化;
(2)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式;
Ⅱ.A、B、C、D、E为原子序数依次增大的五种短周期元素,C与B、E在周期表中相邻,且C、E同主族,且C、E同主族,原子序数C大于A、B小于E,则C处于第二周期,E处于第三周期,所以B、C、E在周期表中的位置关系为
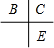 ,A和D最外层电子数相同,则二者处于同族,原子序数D大于C且小于E,则D为第三周期,其中仅含一种金属元素,D应为金属,B、C的最外层电子数之和等于D的原子核外电子数,D的核外电子数为奇数,则D为钠元素或铝元素,若D为钠元素,则A为氢元素,B为氮元素,C为氧元素,E为硫元素,A和C可形成化合物H2O、H2O2,符合题意.若D为铝元素,则A为硼元素,B为氧元素,C为氟元素,E为氯元素,A和C形成化合物,不符合题意,故A为氢元素,B为氮元素,C为氧元素,D为钠元素,E为硫元素;甲为H2O;乙为H2O2.
,A和D最外层电子数相同,则二者处于同族,原子序数D大于C且小于E,则D为第三周期,其中仅含一种金属元素,D应为金属,B、C的最外层电子数之和等于D的原子核外电子数,D的核外电子数为奇数,则D为钠元素或铝元素,若D为钠元素,则A为氢元素,B为氮元素,C为氧元素,E为硫元素,A和C可形成化合物H2O、H2O2,符合题意.若D为铝元素,则A为硼元素,B为氧元素,C为氟元素,E为氯元素,A和C形成化合物,不符合题意,故A为氢元素,B为氮元素,C为氧元素,D为钠元素,E为硫元素;甲为H2O;乙为H2O2.解答:
解:Ⅰ.(1)①已知反应为:2NO(g)+2CO(g)
2CO2(g)+N2(g),则K=
,故答案为:K=
;
②a、到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,未到达平衡,故a错误;
b、该反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度为定值,达最高,平衡常数不变,为最小,图象与实际符合,故b正确,
c、t1时刻后二氧化碳、NO的物质的量发生变化,t1时刻未到达平衡状态,故c错误;
d、NO的质量分数为定值,t1时刻处于平衡状态,故d正确;
故答案为:bd;
(2)已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H1=-867kJ/mol①
2NO2(g)?N2O4(g)△H2=-56.9kJ/mol②
H2O(g)=H2O(l)△H=-44.0kJ/mol③
根据盖斯定律,①-②+④×2可得CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g),故△H=-867kJ/mol-(-56.9kJ/mol)+2(-44.0)kJ/mol=-898.1kJ/mol 即CH4(g)+N2O4(g)═N2(g)+2H2O(g)+CO2(g)△H=-898.1kJ/mol,
故答案为:CH4(g)+N2O4(g)═N2(g)+2H2O(g)+CO2(g)△H=-898.1kJ/mol;
Ⅱ.A、B、C、D、E为原子序数依次增大的五种短周期元素,C与B、E在周期表中相邻,且C、E同主族,且C、E同主族,原子序数C大于A、B小于E,则C处于第二周期,E处于第三周期,所以B、C、E在周期表中的位置关系为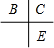 ,A和D最外层电子数相同,则二者处于同族,原子序数D大于C且小于E,则D为第三周期,其中仅含一种金属元素,D应为金属,B、C的最外层电子数之和等于D的原子核外电子数,D的核外电子数为奇数,则D为钠元素或铝元素,若D为钠元素,则A为氢元素,B为氮元素,C为氧元素,E为硫元素,A和C可形成化合物H2O、H2O2,符合题意.若D为铝元素,则A为硼元素,B为氧元素,C为氟元素,E为氯元素,A和C形成化合物,不符合题意,故A为氢元素,B为氮元素,C为氧元素,D为钠元素,E为硫元素;甲为H2O;乙为H2O2;
,A和D最外层电子数相同,则二者处于同族,原子序数D大于C且小于E,则D为第三周期,其中仅含一种金属元素,D应为金属,B、C的最外层电子数之和等于D的原子核外电子数,D的核外电子数为奇数,则D为钠元素或铝元素,若D为钠元素,则A为氢元素,B为氮元素,C为氧元素,E为硫元素,A和C可形成化合物H2O、H2O2,符合题意.若D为铝元素,则A为硼元素,B为氧元素,C为氟元素,E为氯元素,A和C形成化合物,不符合题意,故A为氢元素,B为氮元素,C为氧元素,D为钠元素,E为硫元素;甲为H2O;乙为H2O2;
(1)已知C、D、E三种原子对应的离子为O2-、Na+、S2-,则离子半径由大到小的顺序是S2->O2->Na+; A、B、C分别为H、N、O,则种元素按1:7:12的质量比组成的化合物为NH4NO3,其含有化学键为离子键、共价键、配位键;
故答案为:S2->O2->Na+; 离子键、共价键、配位键;
(2)易拉罐一般为铝制的,铝与A、C、D组成的化合物溶液即NaOH溶液反应,其离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)氢气、氧气与烧碱溶液,组成的燃料电池,氢气在负极放电,在碱性条件下生成水,电解反应式为:H2+2OH--2e-=2H2O;
用该电池电解1L1mol/LNaCl溶液,当消耗标准状况下1.12LH2时,氢气的物质的量=
=0.05mol,生成的NaOH物质的量=0.05mol×2=0.1mol,故n(OH-)=0.1mol/L,则c(H+)=
=10-13,故溶液的pH=-lg10-13=13,
故答案为:H2-2e+2OH-=2H2O;13.
| 催化剂 |
| c2(CO2)?c(N2) |
| c2(NO)?c2(CO) |
| c2(CO2)?c(N2) |
| c2(NO)?c2(CO) |
②a、到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,未到达平衡,故a错误;
b、该反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度为定值,达最高,平衡常数不变,为最小,图象与实际符合,故b正确,
c、t1时刻后二氧化碳、NO的物质的量发生变化,t1时刻未到达平衡状态,故c错误;
d、NO的质量分数为定值,t1时刻处于平衡状态,故d正确;
故答案为:bd;
(2)已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H1=-867kJ/mol①
2NO2(g)?N2O4(g)△H2=-56.9kJ/mol②
H2O(g)=H2O(l)△H=-44.0kJ/mol③
根据盖斯定律,①-②+④×2可得CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g),故△H=-867kJ/mol-(-56.9kJ/mol)+2(-44.0)kJ/mol=-898.1kJ/mol 即CH4(g)+N2O4(g)═N2(g)+2H2O(g)+CO2(g)△H=-898.1kJ/mol,
故答案为:CH4(g)+N2O4(g)═N2(g)+2H2O(g)+CO2(g)△H=-898.1kJ/mol;
Ⅱ.A、B、C、D、E为原子序数依次增大的五种短周期元素,C与B、E在周期表中相邻,且C、E同主族,且C、E同主族,原子序数C大于A、B小于E,则C处于第二周期,E处于第三周期,所以B、C、E在周期表中的位置关系为
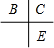 ,A和D最外层电子数相同,则二者处于同族,原子序数D大于C且小于E,则D为第三周期,其中仅含一种金属元素,D应为金属,B、C的最外层电子数之和等于D的原子核外电子数,D的核外电子数为奇数,则D为钠元素或铝元素,若D为钠元素,则A为氢元素,B为氮元素,C为氧元素,E为硫元素,A和C可形成化合物H2O、H2O2,符合题意.若D为铝元素,则A为硼元素,B为氧元素,C为氟元素,E为氯元素,A和C形成化合物,不符合题意,故A为氢元素,B为氮元素,C为氧元素,D为钠元素,E为硫元素;甲为H2O;乙为H2O2;
,A和D最外层电子数相同,则二者处于同族,原子序数D大于C且小于E,则D为第三周期,其中仅含一种金属元素,D应为金属,B、C的最外层电子数之和等于D的原子核外电子数,D的核外电子数为奇数,则D为钠元素或铝元素,若D为钠元素,则A为氢元素,B为氮元素,C为氧元素,E为硫元素,A和C可形成化合物H2O、H2O2,符合题意.若D为铝元素,则A为硼元素,B为氧元素,C为氟元素,E为氯元素,A和C形成化合物,不符合题意,故A为氢元素,B为氮元素,C为氧元素,D为钠元素,E为硫元素;甲为H2O;乙为H2O2;(1)已知C、D、E三种原子对应的离子为O2-、Na+、S2-,则离子半径由大到小的顺序是S2->O2->Na+; A、B、C分别为H、N、O,则种元素按1:7:12的质量比组成的化合物为NH4NO3,其含有化学键为离子键、共价键、配位键;
故答案为:S2->O2->Na+; 离子键、共价键、配位键;
(2)易拉罐一般为铝制的,铝与A、C、D组成的化合物溶液即NaOH溶液反应,其离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)氢气、氧气与烧碱溶液,组成的燃料电池,氢气在负极放电,在碱性条件下生成水,电解反应式为:H2+2OH--2e-=2H2O;
用该电池电解1L1mol/LNaCl溶液,当消耗标准状况下1.12LH2时,氢气的物质的量=
| 1.12L |
| 22.4L/mol |
| 10-14 |
| 0.1 |
故答案为:H2-2e+2OH-=2H2O;13.
点评:本题考查化学平衡图象、影响化学平衡的因素、热化学方程式书写、原子结构与元素位置关系、离子半径比较、化学键、原电池和电解池原理的应用等,题目综合性较大,难度较大,是对知识的综合利用、注意基础知识的理解掌握.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
某陨石中含有镁的一种放射性同位素
Mg,下列对其描述正确的是( )
28 12 |
| A、中子数28 |
| B、核电荷数12 |
| C、电子数28 |
| D、中子数与质子数之差16 |
下列离子方程式书写不正确的是( )
| A、NaHCO3溶液与过量的Ca(OH)2溶液反应:HCO3-+OH-+Ca2+=CaCO3↓+H2O |
| B、向1mol AlCl3溶液中加入2mol NaOH:Al3++4OH-=AlO2-+2H2O |
| C、铜片插入氯化铁溶液中:2Fe3++Cu=2Fe2++Cu2+ |
| D、少量CO2通入NaOH溶液中:CO2+2OH-=CO32-+H2O |
下列有关物质的性质或结构的说法正确的是( )
| A、1531P是一种广泛应用于含磷化合物的结构分析和医疗诊断的核素,其原子核内含有15个中子 |
| B、Cl与I同属于ⅦA族元素,则两者最高价氧化物对应水化物的酸性:HClO4<HIO4 |
| C、Li、Na、K、Rb、Cs都属于碱金属元素,它们单质的还原性随原子序数的增大而减弱 |
| D、Na的原子半径比Cl的大,但Na+的半径比Cl-的小 |