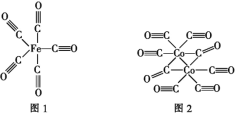
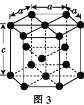
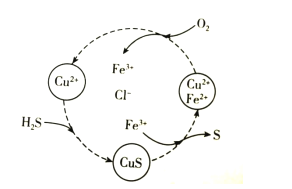
��Ŀ����
����Ŀ�������£���ʢ50mL0.100mol��L-1����������ձ��и������ٵμ�50mL������ˮ��0.100mol��L-1�������Һ�������ҺpH��ʱ��仯��ͼ��ʾ����֪Ka(CH3COOH)=1.8��10-5��Kb(NH3��H2O)=1.8��10-5������˵����ȷ���ǣ� ��
A.����X������μ�����ˮ��pH�仯ͼ���μӹ�������Һ��������Ũ����С
B.����Y�ϵ�����һ����Һ�о�����c(CH3COO-)<c(NH4+)
C.a����Һ��n(Cl-)��n(CH3COO-)��n(OH)-n(NH4+)=0.01mol
D.b����Һ��ˮ�����c(H+)��c���102.37��
���𰸡�B
��������
HCl�м�ˮ���500mL��������101������ʱPH=1+1=2�����ڼ�50mlˮ����Һ���ԶԶС��500mL�����Լ�50mLˮ����ҺPH��2С����X������50mLˮ�ģ�Y�������˴���淋ģ��ݴ˻ش�
A���ɷ�����֪����X�������еμ�ˮ��pH�仯ͼ��HCl��ϡ�ͣ�H+��Cl-Ũ�ȼ�С������Kw=[H+]��[OH-]��֪��[OH-]������A����
B. ������50mL���ᰴʱ������狀�HClǡ����ȫ��Ӧ������Ϊ�����ʵ�����Ũ�Ⱦ�Ϊ0.05mol��L-1��CH3COOH��NH4Cl��CH3COO-Ũ�������ΪKa(CH3COOH)=1.8��10-5������C(CH3COO-)=![]() ����C(NH4+)��0.05mol/L������Y������һ��C(NH4+)> C(CH3COO-)��B��ȷ��
����C(NH4+)��0.05mol/L������Y������һ��C(NH4+)> C(CH3COO-)��B��ȷ��
C. a����Һ�е���غ�Ϊ��n(Cl-)��n(CH3COO-)��n(OH)= n(NH4+)+n(H+)������n(Cl-)��n(CH3COO-)��n(OH)-n(NH4+)= n(H+)��a��pH=2��C(H+)=0.01mol��L-1����Һ�����ԼΪ100ml��n(H+)=0.01mol��L-1��0.1L=0.001mol������n(Cl-)��n(CH3COO-)��n(OH)-n(NH4+)=0.001mol��C����
D. b��λHCl��Һ��ˮ�ĵ����ܵ�HCl�����H+���ƣ�c�㣺һ����CH3COOHΪ���ᣬ��һ���棬NH4+ˮ��ٽ�ˮ�ĵ��룬�ۺ�����b��ˮ�ĵ��������Ƴ̶ȴ���c�㣬D����
��ѡB��

����Ŀ��(1)t1 ��ʱ���ܱ������У�ͨ��һ������CO��H2O���������·�Ӧ��CO(g)+H2O(g)![]() CO2(g)+H2(g) ��H<0�������и�����Ũ��(��λ�� mol��L-1)�仯���±���ʾ��
CO2(g)+H2(g) ��H<0�������и�����Ũ��(��λ�� mol��L-1)�仯���±���ʾ��
ʱ��(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
��һ������ƽ��״̬��ʱ���Ϊ____________��
��5~6 minʱ����ڣ�ƽ���ƶ�����Ϊ_______________ (���������ƶ������������ƶ���)�����ݱ��������жϣ�ƽ���ƶ���ԭ����________(����ĸ���)��
a.������H2O(g)���� b.��������Ũ�� c.ʹ�ô��� d.�����¶�
��t2 ��ʱ(t2>t1)������ͬ�����·���������Ӧ����ƽ��ʱ��COŨ��________c1(����>����<������=��)��
(2)��֪��ӦFe(s)+CO2(g)![]() FeO(s)+CO(g)��ƽ�ⳣ�����¶ȱ仯�����ͼ��ʾ��
FeO(s)+CO(g)��ƽ�ⳣ�����¶ȱ仯�����ͼ��ʾ��

����CO��ԭFeO�Ʊ�Fe�ķ�Ӧ��___________ (��������������������)��Ӧ��
���¶�ΪT2ʱ��ʵ���ø÷�Ӧ��ϵ��COŨ��ΪCO2��2.5������T2______T1(����>����<������=��)��
(3)��ҵ�ϳ���CO��CO2��H2�ϳɼ״�ȼ�ϣ���ԭ��Ϊ��
��CO(g)+2H2(g)![]() CH3OH(g) ��H<0����CO2(g)+H2(g)
CH3OH(g) ��H<0����CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H>0
CO(g)+H2O(g) ��H>0
������������ɹ̶�ʱ��COƽ��ת����(��)���¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��

ͼ�е�ѹǿ�ɴ�С��˳��Ϊ____________���ж�������_________________________��
�Խ���COƽ��ת�������¶����߶���С��ԭ����_______________________��
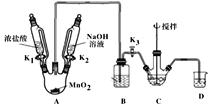
����Ŀ�������ƣ�NaBiO3���Ƿ�����ѧ�е���Ҫ�Լ�����ˮ�л����ֽ⣬����ˮ������Ѹ�ٷֽ⡣ij��ȤС�����ʵ����ȡ�����Ʋ�̽����Ӧ�á��ش��������⣺
��.��ȡ������
��ȡװ����ͼ�����Ⱥͼг���������ȥ�������������������£�
���� | NaBiO3 | Bi(OH)3 |
���� | ��������ˮ��dz��ɫ | ������ˮ����ɫ |
��1��Bװ�����ڳ�ȥHCl��ʢ�ŵ��Լ���___��
��2��C��ʢ��Bi(OH)3��NaOH������Cl2��Ӧ����NaBiO3����Ӧ�����ӷ���ʽΪ___��
��3�����۲쵽___��������ʱ�����Գ����ж�C�з�Ӧ�Ѿ���ɣ�
��4�����װ��ǰ�����ȳ�ȥ��ƿ�в���Cl2������Ⱦ��������ȥCl2�IJ�����___��
��5����Ӧ������Ϊ��װ��C�л�þ����ܶ�IJ�Ʒ����Ҫ�IJ�����___��
��.�����Ƶ�Ӧ����������Mn2+
��6��������Һ�м��������ƾ��壬�������ữ����Һ��Ϊ�Ϻ�ɫ��֤������Һ�д���Mn2+��
�ٲ����Ϻ�ɫ��������ӷ���ʽΪ___��
��ijͬѧ�ڽ�Ũ��MnSO4��Һ�м��������ƾ��壬�������ữ�����û���Ϻ�ɫ���֣����۲쵽��ɫ���壨MnO2�����ɡ���������������ӷ�Ӧ����ʽΪ___��
��.��Ʒ���ȵIJⶨ
��7��ȡ����NaBiO3��Ʒwg����������ϡ�����MnSO4ϡ��Һʹ����ȫ��Ӧ������cmo1��L-1��H2C2O4����Һ�ζ����ɵ�MnO4-����֪��H2C2O4+MnO4-����CO2+Mn2++H2O��δ��ƽ��������Һ�Ϻ�ɫǡ����ȥʱ������vmL����Һ��
�ò�Ʒ�Ĵ���Ϊ___���ú�w��c��v�Ĵ���ʽ��ʾ����