题目内容
8.22%的NaNO3溶液150mL中加入100g水后所得溶液质量分数为14%,则原NaNO3溶液物质的量浓度约为( ) mol/L.| A. | 1.0 | B. | 2.0 | C. | 3.0 | D. | 4.0 |
分析 可假设原溶液的质量为mg,根据溶液稀释前后溶质的质量不变计算m,根据质量分数计算NaNO3的质量,根据n=$\frac{m}{M}$计算NaNO3的物质的量,再根据c=$\frac{n}{V}$计算.
解答 解:设原溶液的质量为mg,
则根据溶液稀释前后溶质的质量不变,则m×22%=(m+100)×14%,解之得m=175,
则在150mL溶质的质量分数为22%的NaNO3溶液中,含NaNO3的质量为:175×22%=38.5g,
NaNO3的物质的量为:$\frac{38.5g}{85g/mol}$=0.45mol,
原溶液的物质的量浓度是:$\frac{0.45mol}{0.15L}$=3mol/L,
故选C.
点评 本题考查物质的量浓度的计算,题目难度不大,明确溶液稀释过程中溶质的物质的量不变为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
2.下列说法中正确的是( )
| A. | 对于2SO2(g)+O2(g)?2SO3(g)△H=-QkJ/mol.若反应中充入1mol SO2和足量的氧气反应时.放出的热量一定是Q/2kJ | |
| B. | 热化学方程式中的化学计量数表示反应物及生成物的物质的量,可以是分数 | |
| C. | 1molH2与0.5加O2反应放出的热量就是H2的燃烧热 | |
| D. | 1mol H2SO4溶液与1mol Ba(OH)2溶液反应生成BaSO4沉淀时放出的热量叫中和热 |
19.室温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
(1)从甲组情况分析,如何判断HA是强酸还是弱酸?a=7时HA是强酸,a>7时HA是弱酸
(2)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=9.9×10-7mol/L.
| 实验 编号 | HA的物质的量 浓度(mol/L) | NaOH的物质的 量浓度(mol/L) | 混合后 溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=8 |
(2)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=9.9×10-7mol/L.
3.下列不属于电解质的是( )
| A. | 水 | B. | 碳酸钙 | C. | 稀硫酸 | D. | 醋酸 |
17.下列物质中含氢原子数最多的是( )
| A. | 2mol CH4 | B. | 3mol NH3 | C. | 4mol H3PO4 | D. | 5mol H2 |

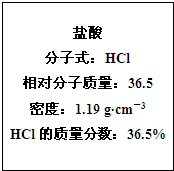 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: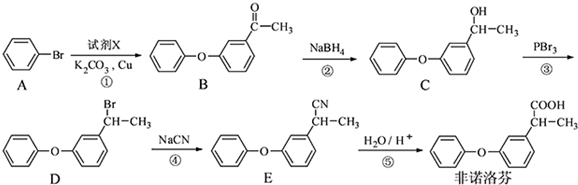
 .
.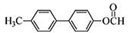 .
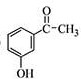
.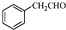 为原料制备
为原料制备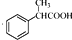 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).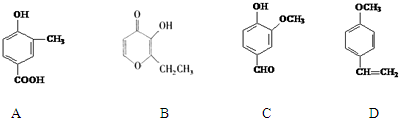
 ;
;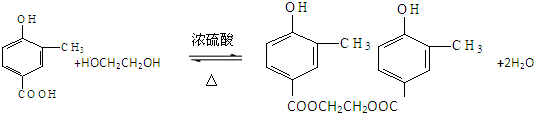 .
.