题目内容
13.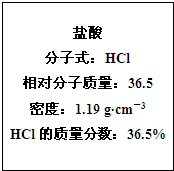 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:(1)该浓盐酸中HCl的物质的量浓度为11.9mol•L-1.
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是BD.
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400mol•L-1的稀盐酸.
①该学生需要量取16.8mL上述浓盐酸进行配制.
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(填A表示“偏大”、填B表示“偏小”、填C表示“无影响”).
a.用量筒量取浓盐酸时俯视观察凹液面.B
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水.B
(4)①假设该同学成功配制了0.400mol•L-1的盐酸,他又用该盐酸中和含0.4g NaOH的NaOH溶液,则该同学需取25mL盐酸.
②假设该同学用新配制的盐酸中和含0.4g NaOH的氢氧化钠溶液,发现比①中所求体积偏小,则可能的原因是c.
A.浓盐酸挥发,浓度不足 B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出.
分析 (1)依据C=$\frac{1000ρω}{M}$计算浓盐酸的物质的量浓度;
(2)根据该物理量是否有溶液的体积有关判断;
(3)①依据溶液稀释过程中所含溶质的物质的量不变计算需要浓盐酸体积;
②分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(4)①根据n(HCl)=n(NaOH)计算;
②盐酸体积减少,说明标准液盐酸体积读数减小,据此解答.
解答 解:(1)浓盐酸的物质的量浓度C=$\frac{1000×1.19×36.5%}{36.5}$=11.9mol/L;
故答案为:11.9;
(2)A.溶液中HCl的物质的量=nV,所以与溶液的体积有关,故A不选;
B.溶液具有均一性,与浓度溶液的体积无关,故B选;
C.溶液中Cl-的数目=nNA=CVNA,所以与溶液的体积有关,故c不选;
D.溶液的密度与溶液的体积无关,故D选;
故选BD;
(3)①设需要浓盐酸体积V,则依据溶液稀释过程中所含溶质的物质的量不变得:V×11.9mol/L=0.400mol•L-1×500mL,解得V=16.8mL;
故答案为:16.8;
1②a.用量筒量取浓盐酸时俯视观察凹液面,导致量取的浓盐酸体积偏小,溶质的物质的量偏小,溶液浓度偏低,故选B;
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水,导致溶液体积偏大,溶液浓度偏低,故选B;
(4)①n(HCl)=n(NaOH)=0.01mol,V(HCl)=$\frac{0.01mol}{0.400mol•{L}^{-1}}$=0.025L=25mL,
故答案为:25;
②消耗的标准液盐酸体积减少,说明读数时标准液的体积比实际体积减少了,
A、浓盐酸挥发,浓度不足,配制的标准液浓度减小,滴定时消耗盐酸体积变大,故A不选;
B、配制溶液时,未洗涤烧杯,标准液浓度减小,消耗体积增大,故B不选;
C、配制溶液时,俯视容量瓶刻度线,配制的标准液浓度变大,滴定时消耗的体积减小,故C选;
D、加水时超过刻度线,用胶头滴管吸出,标准液浓度减小,滴定时消耗标准液体积增大,故D不选;
故选:C.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作过程是解题关键,题目难度不大,注意误差分析方法.

 阅读快车系列答案
阅读快车系列答案| A. | 1.0 | B. | 2.0 | C. | 3.0 | D. | 4.0 |
(1)3Cl2+2NH3═N2+6HCl (2)HCl+NH3═NH4Cl (氯化氢遇氨气产生白烟).下列说法错误的是
( )
| A. | 反应(1)(2)中NH3都显还原性 | B. | 该反应中Cl2显强氧化性 | ||
| C. | 反应(1)属于置换反应 | D. | 生成2mol N2时转移12mol电子 |
| A. | CO2+H2O═H2CO3 | B. | NH4HCO3═CO2↑+H2O+NH3↑ | ||
| C. | Zn+H2SO4═H2↑+ZnSO4 | D. | Cu(OH)2+2HCl═CuCl2+2H2O |
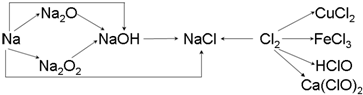
 2FeCl3.
2FeCl3.