题目内容
16.某实验小组欲探究碳与浓硝酸反应的情况.甲同学设计了图1装置,认为若有红棕色气体产生就说明碳与浓硝酸发生了反应.(1)碳与浓硝酸反应的方程式C+4HNO3 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+CO2↑+2H2O甲同学的实验应该在通风橱中进行,才符合化学实验安全性的要求.
(2)乙同学认为红棕色气体不一定是碳与浓硝酸发生反应而得,所以他认为甲同学观点是错误的,他的理由是4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+2H2O(用化学方程式表示),所以他认为应该检验CO2(填化学式)的产生来证明碳与浓硝酸反应.为此乙同学查阅相关资料得知“0℃时四氧化二氮为液体”,从而改进了实验装置如图2所示.
(3)为了减少干扰,对于A装置有下面4种操作方案,其中最合理的是(填写数字序号)②.
①将木炭与浓硝酸一同放在装置中加热;②先加热木炭,再将木炭投入冷浓硝酸.③先加热木炭,再加入冷浓硝酸;④先加热浓硝酸,然后将木炭投入其中;
(4)请用平衡移动原理解释B装置的作用常温下存在平衡体系:2NO2?N2O4,降低温度N2O4液化,平衡右移,除去混合气体中的NO2(结合方程式与文字表述).
(5)C装置中出现的现象是C中溶液变浑浊(或产生白色沉淀),经检测C的溶液中还含有少量氮元素,只以NO3-形式存在,写出生成该离子的化学方程式4NO2+O2+4OH-=4NO3-+2H2O.

分析 (1)碳与浓硝酸反应生成二氧化碳、二氧化氮和水,二氧化氮有毒;
(2)浓硝酸不稳定,加热易分解;要检验该反应发生则要检验二氧化碳;
(3)浓硝酸不稳定,加热易分解,为防止干扰,应该防止浓硝酸分解;
(4)温度低,平衡向生成四氧化二氮的方向移动;
(5)二氧化碳能和氢氧化钡溶液反应生成难溶性的碳酸钡,二氧化氮、氧气和水反应生成硝酸,硝酸和氢氧化钡发生酸碱中和反应.
解答 解:(1)碳与浓硝酸反应的方程式为C+4HNO3 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+CO2↑+2H2O,二氧化氮有毒,则甲同学的实验应该在通风橱中进行,才符合化学实验安全性的要求,
故答案为:C+4HNO3 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+CO2↑+2H2O;通风橱;
(2)浓硝酸不稳定,加热易分解生成二氧化氮,浓硝酸和碳在加热条件下反应也生成二氧化氮,所以对实验造成干扰,反应方程式为4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+2H2O,所以要想检验浓硝酸和碳反应不能根据是否生成二氧化氮判断,要根据CO2判断,
故答案为:4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+2H2O;CO2;
(3)浓硝酸不稳定,加热易分解,为防止干扰,应该防止浓硝酸分解,但浓硝酸和碳的反应必须在加热条件下才能发生,所以要先将炭加热,再将碳投入冷的浓硝酸中,
故答案为:②;
(4)根据题给信息知,0℃时四氧化二氮为液体,所以温度越低,二氧化氮越向四氧化二氮方向移动,所以要使用冰水混合物冷却二氧化氮气体,从而将混合气体中的二氧化氮除去,防止二氧化碳的检验,
故答案为:常温下存在平衡体系:2NO2?N2O4,降低温度N2O4液化,平衡右移,除去混合气体中的NO2;
(5)氧化碳能和氢氧化钡溶液反应生成难溶性的碳酸钡,所以看到的现象是:C中溶液变浑浊,二氧化氮、氧气和水反应生成硝酸,硝酸和氢氧化钡发生酸碱中和反应,所以溶液呈出现硝酸根离子,反应方程式为4NO2+O2+2Ba(OH)2=2Ba(NO3)2+2H2O,离子反应为4NO2+O2+4OH-=4NO3-+2H2O,
故答案为:C中溶液变浑浊(或产生白色沉淀);4NO2+O2+4OH-=4NO3-+2H2O.
点评 本题考查性质实验方案的设计,为高频考点,把握图中装置的作用、反应原理及实验技能为解答的关键,侧重分析与实验能力的综合考查,题目难度中等.

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案| A. | 1.0 | B. | 2.0 | C. | 3.0 | D. | 4.0 |
(1)3Cl2+2NH3═N2+6HCl (2)HCl+NH3═NH4Cl (氯化氢遇氨气产生白烟).下列说法错误的是
( )
| A. | 反应(1)(2)中NH3都显还原性 | B. | 该反应中Cl2显强氧化性 | ||
| C. | 反应(1)属于置换反应 | D. | 生成2mol N2时转移12mol电子 |
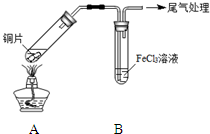 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验.
| 步骤① | 配制1mol•L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A. |
写出装置A中产生SO2的化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
根据该小组同学的预测现象,他们认为该反应的离子方程式为:2Fe3++SO2+2H2O=SO42-+2Fe2++4H+.
(2)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象.将混合液放置12小时,溶液才变成浅绿色.
【查阅资料】Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+.生成Fe(HSO3)2+离子的
反应为可逆反应.
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因:H2O+SO2?H2SO3,H2SO3?H++HSO3-,Fe3++HSO3-?Fe(HSO3)2+.
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式:Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+.
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤③的实验.
| 步骤② | 往5mL1mol•L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热3min,溶液颜色变为浅绿色. |
| 步骤③ | 往5mL重新配制的1mol•L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.几分钟后,发现溶液颜色变成浅绿色. |
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
II.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
III.加热、提高FeCl3溶液的酸性会缩短浅绿色出现的时间.

 2FeCl3.
2FeCl3.