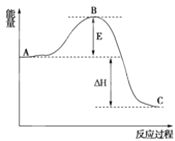
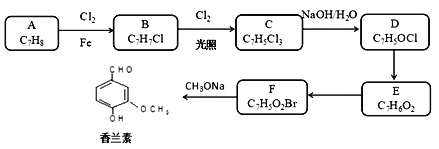
题目内容
【题目】某校化学兴趣小组为研究Cl2的性质并制备氯水,用如图所示装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。

(1)加入药品前,检查I中气体发生装置气密性的操作是__。
(2)装置Ⅰ中发生反应的化学方程式为__。
(3)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为应在__和___(填装置序号)之间添加洗气装置,该装置的作用是___。
(4)装置V中NaOH溶液的作用是__,相关反应的化学方程式为___。
(5)反应完毕,为探究装置Ⅳ中溶质的成分,需要的试剂主要有__。
【答案】关闭c,打开分液漏斗的活塞,向分液漏斗中加入适量水,一段时间后分液漏斗液面不再发生变化 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O Ⅱ Ⅲ 干燥Cl2 吸收尾气,防止污染环境 Cl2+2NaOH=NaCl+NaClO+H2O pH试纸、品红溶液、AgNO3溶液(顺序可调)或紫色石蕊溶液、AgNO3溶液(顺序可调)
MnCl2+Cl2↑+2H2O Ⅱ Ⅲ 干燥Cl2 吸收尾气,防止污染环境 Cl2+2NaOH=NaCl+NaClO+H2O pH试纸、品红溶液、AgNO3溶液(顺序可调)或紫色石蕊溶液、AgNO3溶液(顺序可调)
【解析】
(1)若装置I气密性良好,关闭c,打开分液漏斗的活塞,分液漏斗中液体不能顺利流入烧瓶中;
(2)装置Ⅰ中二氧化锰和浓盐酸反应生成氯化锰、氯气和水;
(3)装置Ⅱ中有水,可能有水蒸气进入Ⅲ;
(4)装置V中NaOH溶液能与氯气反应生成氯化钠、次氯酸钠和水;
(5)装置Ⅳ中溶质是盐酸和次氯酸。
(1)关闭c,打开分液漏斗的活塞,向分液漏斗中加入适量水,一段时间后分液漏斗液面不再发生变化,说明装置I气密性良好;
(2)装置Ⅰ中二氧化锰和浓盐酸反应生成氯化锰、氯气和水,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(3)装置Ⅱ中有水,有水蒸气进入Ⅲ,所以未观察到“a无明显变化”这一预期现象;应在Ⅱ和Ⅲ之间添加盛有浓硫酸的洗气瓶,用于干燥Cl2;
(4)装置V中NaOH溶液能与氯气反应生成氯化钠、次氯酸钠和水,反应的化学方程式是Cl2+2NaOH=NaCl+NaClO+H2O;氯气有毒,不能排放到空气中,所以装置V中NaOH溶液的作用是吸收尾气,防止污染环境;
(5)加入紫色石蕊溶液,先变红后褪色,说明含有氢离子、次氯酸,再加入硝酸银溶液,有白色沉淀生成,证明含有氯离子,所以需要加入的试剂是紫色石蕊溶液、AgNO3溶液。

 天天向上口算本系列答案
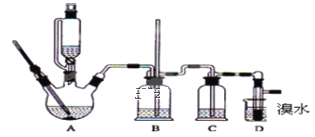
天天向上口算本系列答案【题目】实验室用少量的溴水和足量的乙烯制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -1l6 |
回答下列问题:
(1)烧瓶A中发生的主要的反应方程式:___________________________________。
(2)安全瓶B可以防倒吸,并可以检查实验进行时试管D是否发生堵塞.请写出发生堵塞时瓶B中的现象:______________________________________________________。
(3)在装置C中应加入_____(填字母),(a.水 b.浓硫酸 c.氢氧化钠溶液)其目的是 ___________________________________________________________________。
(4)若产物中有少量副产物乙醚,可用 ________________ 的方法除去。
(5)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是 _________________________________________________________________________。