��Ŀ����
����Ŀ�����ͼ����������⡣
��1�����������䡱�еġ�����ָ��Ȼ��������Ҫ�ɷֵĽṹʽ��__________��һ�����ĸ�����ȼ�չ��̵������仯��ͼ1��ʾ����ͼ�п��Զ���E1 E2����������������÷�Ӧ_______ ����ų��������ա���������
��2��CH4��Cl2������һϵ�з�Ӧ����________(�Ӧ����)��Ӧ����д��CH4��Cl2��Ӧ����һ�ȼ���Ļ�ѧ����ʽ��_______________________________��
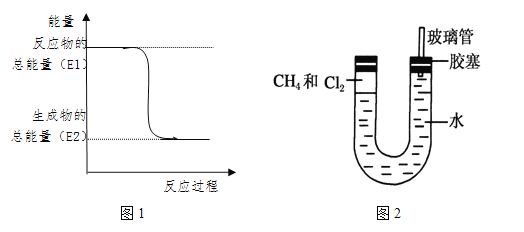
��3��������м���������Ļ�������װ�÷������й����ĵط����û�����建���ط�Ӧһ��ʱ�䡣��������Сʱ�ķ�Ӧ��ͼ2��U���Ҷ˵IJ�������ˮ���ı仯�� ������������½�������
���𰸡���1�� 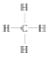 , E1��E2 ���ų�
, E1��E2 ���ų�
��2��ȡ����CH4+Cl2��CH3Cl+HCl��2�֣� ��3���½���2�֣�
��������
�����������1����Ȼ������Ҫ�ɷ�Ϊ���飬�ṹʽ�� ����ͼ��֪��Ӧ���������E1>�������������E2���÷�Ӧ�ų�������
����ͼ��֪��Ӧ���������E1>�������������E2���÷�Ӧ�ų�������
��2��CH4��Cl2������һϵ�з�Ӧ����ȡ����Ӧ��CH4��Cl2�ڹ�����������Ӧ����һ�ȼ������Ȼ��⣬��ѧ����ʽΪCH4+Cl2��CH3Cl+HCl��
��3��������������Ӧ���ɶ��ȼ��顢���ȼ�������Ȼ�̼������ΪҺ�壬���ɵ��Ȼ��⼫������ˮ�����U�ι����Һ���Ϸ���ѹ���ͣ�ˮ�����������Ҷ˵IJ�������ˮ���ı仯���½���

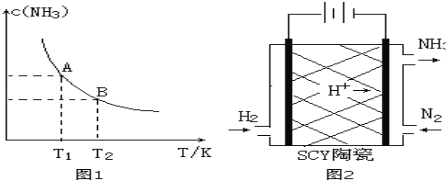
����Ŀ����1����һ�������£���1.00molN2��g����3.00molH2��g�������һ��10.0L�ܱ������У��ڲ�ͬ�¶��´ﵽƽ��ʱNH3��g����ƽ��Ũ����ͼ1��ʾ�������¶�ΪT1ʱƽ���������а������������Ϊ25.0%��
�����¶���T1�仯��T2ʱ��ƽ�ⳣ����ϵK1 K2�����������������=�������ʱ���H 0���������������
���÷�Ӧ��T1�¶���5.00min�ﵽƽ�⣬���ʱ����N2�Ļ�ѧ��Ӧ����Ϊ ��
��T1�¶��¸÷�Ӧ�Ļ�ѧƽ�ⳣ��K1= ��
��2���������¡��˹��̵������о��������ڳ��³�ѹ����������N2�ڴ���������ˮ������Ӧ��2N2��g��+6H2O��l��=4NH3��g��+3O2��g�����˷�Ӧ����S 0�������������������֪��N2��g��+3H2��g��=2NH3��g����H=a kJ/mol 2H2��g��+O2��g��=2H2O��l����H=b kJ/mol 2N2��g��+6H2O��l��=4NH3��g��+3O2��g������H= ���ú�a��b��ʽ�ӱ�ʾ����
��3����ѧ�Ҳ������Ӹߵ����Ե�SCY�մɣ��ɴ���H+��ʵ���˵��³�ѹ�¸�ת���ʵĵ绯ѧ�ϳɰ�����ʵ��ԭ��ʾ��ͼ��ͼ2��ʾ���������ĵ缫��Ӧʽ�� ��
��4����֪ijЩ���������ˮ�еĵ���ƽ�ⳣ����25�������±���
������� | H2CO3 | NH3.H2O |
����ƽ�ⳣ�� | Ka1=4.30��10-7 Ka2=5.61��10-11 | Kb=1.77��10-5 |
���г�����0��1 mol��L-1�ģ�NH4��2CO3��Һ��
������Һ�� �ԣ���ᡱ�����С����������ԭ���� ��
���ã�NH4��2CO3��Һ�и���Ũ��֮��Ĺ�ϵʽ����ȷ���� ��
A��c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3.H2O)
B��c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C��c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol/L
D��c(NH4+)+c(NH3.H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
E��c(H+)+c(HCO3-)+c(H2CO3)=c(OH-)+c(NH3.H2O)