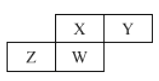
题目内容
【题目】【物质结构与性质】A、B、C、D、E、F为原子序数依次增大的前四周期六种元素,A2-和B+具有相同的电子层结构;C、E为同周期元素,C核外电子总数是最外层电子数的3倍;E元素最外层有一个未成对电子;F的最外层只有1个电子,但次外层有18个电子。
请回答下列问题:
(1)基态F原子的核外电子排布式为 ,F2+能与足量氨水反应得到深蓝色透明溶液,该深蓝色离子的结构式为 。
(2)六种元素中电负性最小的是 ,其中C、D、E的第一电离能由大到小顺序为 (填元素符号)。
(3)A、B 的氢化物所属的晶体类型分别为 。
(4)指出A、D的简单氢化物中沸点较高的物质并说明原因 。
(5)C和E的单质反应可生成组成比为1︰3的化合物,该化合物的立体构型名称为 ,中心原子的杂化轨道类型为 。
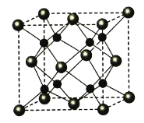
(6)A和B能够形成化合物Y,其晶胞结构如图所示,晶胞参数为a nm,Y的化学式为 ,列式计算晶体Y的密度(可不化简) g·cm-3。
【答案】(1)1s22s22p63s23p33d104s1 (或[Ar] 3d104s1) , 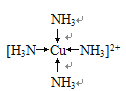 ; (2)Na,Cl>P>S;(3)分子晶体,离子晶体;(4)H2O,水分子间能形成氢键;(5)三角锥形,sp3 ;(6)Na2O,
; (2)Na,Cl>P>S;(3)分子晶体,离子晶体;(4)H2O,水分子间能形成氢键;(5)三角锥形,sp3 ;(6)Na2O,  。
。
【解析】
试题分析:C的核外电子总数是最外层电子数的3倍,推出C为P或Li,如果C为Li,则B为He,不符合题意,则C为P,C、E属于同周期,E最外层有一个未成对电子,推出E为Cl,原子序数依次增大,则D为S,F的最外层只有1个电子,但次外层有18个电子,推出F为Cu,原子序数依次增大,B显+1价,说明位于IA族,推出是B为Na,则A为O,(1)根据上述推断,F为铜,属于第四周期IB族,核外电子排布式为:1s22s22p63s23p33d104s1 (或[Ar] 3d104s1),形成络合物,其结构式为: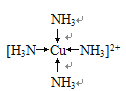 ;(2)金属性越强,电负性越小,金属钠的金属性最强, 故电负性最小的是Na,同周期从左向右电负性增大,即Cl>P>S;(3)A的氢化物是H2O,B的氢化物是NaH,前者属于分子晶体,后者属于离子晶体;(4)A的氢化物是H2O,D的氢化物是H2S,前者含有分子间氢键,后者不含氢键,因此水的沸点高;(5)C和E按1:3组成是PCl3,σ键有3个,孤电子对=1×(5-3×1)/2=1,价层电子对数为4,空间构型属于三角锥型,杂化轨道数=价层电子对数,因此杂化类型是sp3;(6)按照均摊的方法,大球是8×1/8+6×1/2=4,小球在体心,共有8,化学式为Na2O,根据密度的定义,晶体Y的密度是
;(2)金属性越强,电负性越小,金属钠的金属性最强, 故电负性最小的是Na,同周期从左向右电负性增大,即Cl>P>S;(3)A的氢化物是H2O,B的氢化物是NaH,前者属于分子晶体,后者属于离子晶体;(4)A的氢化物是H2O,D的氢化物是H2S,前者含有分子间氢键,后者不含氢键,因此水的沸点高;(5)C和E按1:3组成是PCl3,σ键有3个,孤电子对=1×(5-3×1)/2=1,价层电子对数为4,空间构型属于三角锥型,杂化轨道数=价层电子对数,因此杂化类型是sp3;(6)按照均摊的方法,大球是8×1/8+6×1/2=4,小球在体心,共有8,化学式为Na2O,根据密度的定义,晶体Y的密度是 。
。

 阅读快车系列答案
阅读快车系列答案【题目】元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是________。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为________,氧化性最弱的简单阳离子是________。
(3)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是_______________________________ ___;
制铝时,电解Al2O3而不电解AlCl3的原因是____________________________ __。
(4)晶体硅(熔点1410 ℃)是良好的半导体材料,SiCl4(熔点-70 ℃)。由粗硅制纯硅过程如下:
![]()
SiCl4属于 晶体。在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:______________________________________ 。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是________。
a.NH3b.HI c.SO2d.CO2