题目内容
【题目】已知25 ℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,该条件下向100 mL的CaSO4饱和溶液中,加入400 mL 0.01 mol·L-1的Na2SO4溶液,针对此过程的下列叙述正确的是(忽略混合过程中的体积变化)
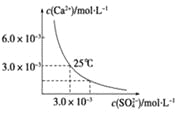
A. 溶液中析出CaSO4沉淀,最终溶液中c(SO42-)较原来大
B. 溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C. 溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO 42-)都变小
D. 溶液中无沉淀析出,但最终溶液中c(SO42-)较原来大
【答案】D
【解析】试题分析:由图示可知,在该条件下,CaSO4饱和溶液中,c(Ca2+)=c(SO42-)=3.0×10-3mol/L,Ksp(CaSO4)=9.0×10-6。当向100 mL该条件下的CaSO4饱和溶液中加入200 mL 0.03mol/L的Na2SO4溶液后,混合液中c(Ca2+)=![]() ,c(SO42-)=
,c(SO42-)=![]() ,溶液中c(Ca2+)c( SO42-)=2.1×10-5>Ksp(CaSO4)=9.0×10-6,所以混合液中有沉淀析出,最终溶液中硫酸根离子浓度增大;答案选A。
,溶液中c(Ca2+)c( SO42-)=2.1×10-5>Ksp(CaSO4)=9.0×10-6,所以混合液中有沉淀析出,最终溶液中硫酸根离子浓度增大;答案选A。
【名师点晴】解题关键是计算混合溶液中钙离子浓度和硫酸根离子浓度。另外需要注意该类试题的图像分析:①曲线上的任意一点,都代表指定温度下的饱和溶液,由对应的离子浓度可求Ksp。②可通过比较、观察得出溶液是否达到饱和状态,是否有沉淀析出。处于曲线上方的点表明溶液处于过饱和状态,一定会有沉淀析出,处于曲线下方的点,则表明溶液处于未饱和状态,不会有沉淀析出。③从图像中找到数据,根据Ksp公式计算得出Ksp的值。④比较溶液的Qc与Ksp的大小,判断溶液中有无沉淀析出。⑤涉及Qc的计算时,所代入的离子浓度一定是混合溶液中的离子浓度,因此计算离子浓度时,所代入的溶液体积也必须是混合液的体积。

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案




