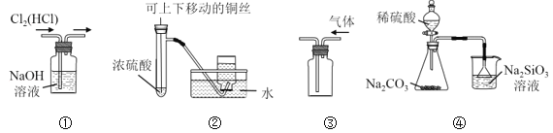
题目内容
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 常温常压下,5.6LO2含有4NA个电子
B. 28gN2、CO和C2H4的混合气体分子总数为NA
C. 标准状况下,22.4L盐酸含有NA个HCl分子
D. 1molNa被完全氧化生成Na2O2,失去2NA个电子
【答案】B
【解析】
标准状况下,5.6LO2的物质的量是0.25mol;N2、CO和C2H4的摩尔质量都是28g/mol;盐酸是液体,不能利用![]() 计算物质的量;Na被完全氧化生成Na2O2,钠元素化合价由0升高为+1;
计算物质的量;Na被完全氧化生成Na2O2,钠元素化合价由0升高为+1;
标准状况下,5.6LO2的物质的量是0.25mol,含有电子数是![]() ,常温常压下,5.6LO2的物质的量不是0.25mol,故A错误;N2、CO和C2H4的摩尔质量都是28g/mol,根据极值法,28gN2、CO和C2H4的混合气体的物质的量是1mol,分子总数为NA,故B正确;盐酸是液体,不能利用
,常温常压下,5.6LO2的物质的量不是0.25mol,故A错误;N2、CO和C2H4的摩尔质量都是28g/mol,根据极值法,28gN2、CO和C2H4的混合气体的物质的量是1mol,分子总数为NA,故B正确;盐酸是液体,不能利用![]() 计算物质的量,故C错误;Na被完全氧化生成Na2O2,钠元素化合价由0升高为+1,1molNa被完全氧化生成Na2O2,失去NA个电子,故D错误。
计算物质的量,故C错误;Na被完全氧化生成Na2O2,钠元素化合价由0升高为+1,1molNa被完全氧化生成Na2O2,失去NA个电子,故D错误。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】已知SO2可以用Fe(NO3)3溶液吸收,某学习小组按如图装置展开探究:
取一定量的铜片于三颈烧瓶中,通入一段时间N2后再加入足量的浓硫酸,加热;装置A中有白雾(硫酸酸雾)生成,装置B中产生白色沉淀。
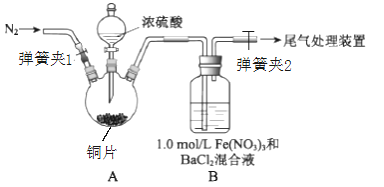
回答下列问题:
(1)装置A中用于添加浓硫酸的仪器名称为_______;检查图中连通装置A、B气密性的方法是___。
(2)加入浓硫酸之前先通入N2一段时间,其目的是___________;排除装置A中白雾影响,可在装置A、B间增加洗气瓶C,则C中盛放的试剂是____________;若用NaOH溶液处理尾气,则发生反应的离子方程式为______________。
(3)经过讨论,该小组对装置B中产生沉淀的原因,提出下列假设(不考虑各因素的叠加):
假设1:装置A中白雾进入装置B中参与了反应
假设2:______________
假设3:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化SO2
(4)请你设计实验验证上述假设3,写出实验步骤、预期现象和结论。
实验步骤(简述操作过程) | 预期现象和结论 |
①测1.0 mol·L-1 Fe(NO3)3溶液的pH ② ____________________ ③ ____________________ ④ ___________________ | ____________________ |