题目内容
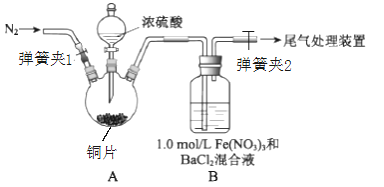
【题目】已知SO2可以用Fe(NO3)3溶液吸收,某学习小组按如图装置展开探究:
取一定量的铜片于三颈烧瓶中,通入一段时间N2后再加入足量的浓硫酸,加热;装置A中有白雾(硫酸酸雾)生成,装置B中产生白色沉淀。
回答下列问题:
(1)装置A中用于添加浓硫酸的仪器名称为_______;检查图中连通装置A、B气密性的方法是___。
(2)加入浓硫酸之前先通入N2一段时间,其目的是___________;排除装置A中白雾影响,可在装置A、B间增加洗气瓶C,则C中盛放的试剂是____________;若用NaOH溶液处理尾气,则发生反应的离子方程式为______________。
(3)经过讨论,该小组对装置B中产生沉淀的原因,提出下列假设(不考虑各因素的叠加):
假设1:装置A中白雾进入装置B中参与了反应
假设2:______________
假设3:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化SO2
(4)请你设计实验验证上述假设3,写出实验步骤、预期现象和结论。
实验步骤(简述操作过程) | 预期现象和结论 |
①测1.0 mol·L-1 Fe(NO3)3溶液的pH ② ____________________ ③ ____________________ ④ ___________________ | ____________________ |
【答案】分液漏斗关闭弹簧夹1和弹簧夹2,打开分液漏斗上方塞子及下方活塞,向三颈烧瓶中加水至水不再流下,分液漏斗中有水且一段时间内液面不下降,则气密性良好,否则不好排出空气饱和NaHSO3溶液SO2+2OH-=SO32-+H2OSO2被Fe3+氧化为SO42-取与Fe(NO3)3溶液中c(NO3-)相同的适量Ba(NO3)2溶液滴入试管中向试管中滴加少许稀硝酸,调节pH与①相同向试管中通入适量SO2气体若有白色沉淀生成,则假设3成立;反之,假设3不成立
【解析】
(1)由图可知,装置A中用于添加浓硫酸的仪器是分液漏斗;检查图中连通装置A、B气密性的方法是关闭弹簧夹1和弹簧夹2,打开分液漏斗活塞,向漏斗中加水至水不流下,停止加水,观察一段时间液面不下降,则气密性好,否则不好。
(2)加入浓硫酸之前先通入N2一段时间,其目的是排除空气的干扰;为排除硫酸酸雾的干扰,增加的洗气瓶C中盛放的溶液需将硫酸吸收但不会吸收SO2,故C中应盛放饱和NaHSO3溶液;SO2与NaOH溶液发生反应的离子方程式为SO2+2OH-=SO32-+H2O。
(3)装置B中生成的白色沉淀为BaSO4,所以溶液中生成了SO42-,结合假设1和假设3以及不考虑各因素的叠加,可推知假设2为SO2被Fe3+氧化为SO42-,与溶液中的Ba2+结合生成BaSO4。
(4)选用溶液显中性的Ba(NO3)2溶液,调节pH至酸性,再通入SO2即可验证假设3是否成立,具体过程为①取与Fe(NO3)3溶液中c(NO3-)相同的适量Ba(NO3)2溶液滴入试管中; ②向试管中滴加少许稀硝酸,调节pH与①相同;③向试管中通入适量SO2气体;结论若有白色沉淀生成,则假设3成立;反之,假设3不成立。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案