题目内容
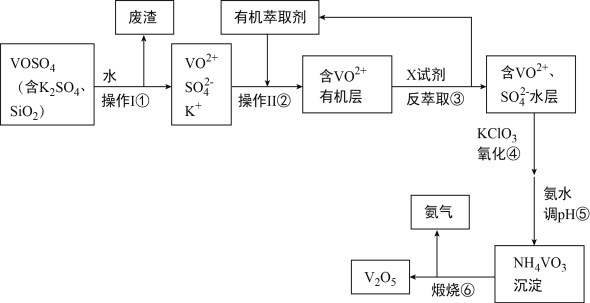
【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如图所示:
回答下列问题:
(1)步骤①所得废渣与强碱反应得离子方程式_______________________________,操作Ⅱ的名称是_______________________。
(2)步骤②、③的变化过程表示为(下式R表示VO2+,HA表示有机萃取剂):R2(SO4)n(水层)+2nHA(有机层)![]() 2RAn(有机层)+nH2SO4(水层,X试剂为__________(写化学式)。
2RAn(有机层)+nH2SO4(水层,X试剂为__________(写化学式)。
(3)按要求完成下列方程式。④的离子方程式为__________________,其中氧化剂与氧化产物的物质的量之比为_____________,若有245gKClO3参与反应时,转移的电子数目为__________。加氨水调节pH过程中涉及的离子方程式为:__________________________________。
(4)该工艺流程中可以循环利用的物质有_________________和_________________。
【答案】SiO2+2OH-=SiO32-+H2O萃取、分液H2SO46VO2++ClO3-+9H2O=6VO3-+Cl-+18H+1:612NANH3·H2O+H+=NH4++H2O NH4++VO3-=NH4VO3↓(填1个即算正确)氨气(或氨水或NH3或NH3·H2O)有机萃取剂(HA或有机溶剂或萃取后的有机层也给分)
【解析】
(1)VOSO4、K2SO4、SiO2中的VOSO4、K2SO4可溶于水,SiO2难溶于水;根据流程图可知操作Ⅱ是加入有机萃取剂后分液;(2)步骤③得到VOSO4,即R2(SO4)n(水层)+2nHA(有机层)![]() 2RAn(有机层)+nH2SO4逆向移动,加入硫酸可使平衡逆向移动;(3)根据流程图,过程④是用KClO3把VO2+氧化为VO3-;KClO3中氯元素化合价降低是氧化剂、VO2+中V元素化合价升高是还原剂,VO3-是氧化产物;
2RAn(有机层)+nH2SO4逆向移动,加入硫酸可使平衡逆向移动;(3)根据流程图,过程④是用KClO3把VO2+氧化为VO3-;KClO3中氯元素化合价降低是氧化剂、VO2+中V元素化合价升高是还原剂,VO3-是氧化产物;![]() ;加氨水调节pH过程中生成NH4VO3沉淀;(4)根据工艺流程图分析可以循环利用的物质。
;加氨水调节pH过程中生成NH4VO3沉淀;(4)根据工艺流程图分析可以循环利用的物质。
(1)VOSO4、K2SO4、SiO2中的VOSO4、K2SO4可溶于水,SiO2难溶于水,所以步骤①所得废渣是SiO2,SiO2与强碱反应生成硅酸盐和水,反应离子方程式是SiO2+2OH-=SiO32-+H2O;根据流程图可知操作Ⅱ是加入有机萃取剂后分液,所以操作Ⅱ是萃取、分液;(2)步骤③得到VOSO4,即R2(SO4)n(水层)+2nHA(有机层)![]() 2RAn(有机层)+nH2SO4逆向移动,加入硫酸可使平衡逆向移动,所试剂X是H2SO4;(3)根据流程图,过程④是用KClO3把VO2+氧化为VO3-,反应的离子方程式为6VO2++ClO3-+9H2O=6VO3-+Cl-+18H+;KClO3中氯元素化合价降低是氧化剂、VO2+中V元素化合价升高,VO2+是还原剂,VO3-是氧化产物,氧化剂与氧化产物的物质的量之比为1:6;
2RAn(有机层)+nH2SO4逆向移动,加入硫酸可使平衡逆向移动,所试剂X是H2SO4;(3)根据流程图,过程④是用KClO3把VO2+氧化为VO3-,反应的离子方程式为6VO2++ClO3-+9H2O=6VO3-+Cl-+18H+;KClO3中氯元素化合价降低是氧化剂、VO2+中V元素化合价升高,VO2+是还原剂,VO3-是氧化产物,氧化剂与氧化产物的物质的量之比为1:6;![]() ,245gKClO3参与反应时,转移的电子数目为
,245gKClO3参与反应时,转移的电子数目为![]() ;加氨水调节pH过程中生成NH4VO3沉淀,反应离子方程式是 NH4++VO3-=NH4VO3↓;(4)根据工艺流程图,该工艺流程中可以循环利用的物质有氨气和有机萃取剂。
;加氨水调节pH过程中生成NH4VO3沉淀,反应离子方程式是 NH4++VO3-=NH4VO3↓;(4)根据工艺流程图,该工艺流程中可以循环利用的物质有氨气和有机萃取剂。