题目内容
11. (1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略溶液体积的变化),
(1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略溶液体积的变化),测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+)>HCl溶液中由水电离出的c(H+)(填“>”、“<”或“=”).
(2)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH<7(填“>7”、“<7”或“无法确定”).
(3)常温下测得浓度为0.1mol•L-1的HA溶液的pH=3,则HA的电离常数Ka=1×10-5
(4)工业上用氯化铁溶液腐蚀铜制电路板.如下图,横坐标为溶液pH,纵坐标为金属离子的物质的量浓度的对数(当溶液中金属离子浓度≤10-5mol/L时,可认为沉淀完全).试回答下列问题
①腐蚀铜板后的溶液中,若Cu2+、Fe3+和Fe2+浓度均为0.1mol/L,今向混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为Cu2+、Fe2+.
②从图中数据计算可得Fe(OH)2的溶度积:Ksp[Fe(OH)2]=1.0×10-17.
分析 (1)将0.2mol/LHCl溶液与0.2mol/LMOH溶液等体积混合,二者恰好反应,反应后溶液显示酸性,说明生成了强酸弱碱盐,常见了水的电离;而氯化氢溶液抑制了水的电离,据此进行判断;
(2)先根据HR为强电解质进行判断,然后得出HR为弱酸,然后根据酸过量得出溶液显示酸性;
(3)pH=3,溶液中A-与H+浓度相同,为10-3mol/L,然后结合HA的电离平衡常数表达式进行计算;
(4)①向混合溶液中通入氨气调节溶液的pH=5.6时,由图象可知易生成Fe(OH)3沉淀;
②根据Ksp[Fe(OH)2]=c(Fe2+)×c2(OH-)计算.
解答 解:(1)常温下,将0.2mol/LHCl溶液与0.2mol/LMOH溶液等体积混合,氯化氢和MOH恰好反应生成MCl,测得混合溶液的pH=6,溶液显示酸性,说明MCl为强酸弱碱盐,溶液中水的电离程度增大,水电离的氢离子为溶液中的氢离子浓度,即c(H+)=1×10-6mol/L;而氯化氢为酸溶液,抑制了水的电离,所以混合溶液中由水电离出的c(H+)大于盐酸中水电离的氢离子浓度,
故答案为:>;
(2)HR若为强电解质,二者都是一元酸或碱,等体积混合后溶液的pH=7,而现在溶液pH不等于7,说明HR为弱电解质,二者混合后溶液中酸过量,反应后溶液显示酸性,溶液pH<7,
故答案为:<7;
(3)常温下测得浓度为0.1mol•L-1的HA溶液的pH=3,溶液中A-与H+浓度相同,为10-3mol/L,HA的浓度约为0.1mol/L,则HA的电离常数Ka=$\frac{1{0}^{-3}×1{0}^{-3}}{0.1}$=1×10-5,
故答案为:1×10-5;
(4)①向混合溶液中通入氨气调节溶液的pH=5.6时,由图象可知易生成Fe(OH)3沉淀,溶液中存在的金属阳离子为:Cu2+、Fe2+,
故答案为:Cu2+、Fe2+;
②由图象可知:c(Fe2+)=1.0×10-5(mol•L-1),c(OH-)=1.0×10-6(mol•L-1)
Ksp[Fe(OH)2]=c(Fe2+)×c2(OH-)=1.0×10-17,
故答案为:1.0×10-17.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算、难溶物溶度积的计算、电离平衡常数的计算等知识,题目难度中等,试题知识点较多,充分考查学生灵活应用基础知识的能力,注意掌握酸碱混合的定性判断方法,明确难溶物溶度积、电离平衡常数的概念及计算方法.

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案| A. | 铝热反应属于氧化还原反应,且生成物的总能量高于反应物的总能量 | |
| B. | 在相同温度和压强下,等质量的硫在足量的纯氧中燃烧放出能量为 Q1,在空气中燃烧放出能量为 Q2,则 Q1=Q2 | |
| C. | 需要加热的反应一定是吸热反应 | |
| D. | 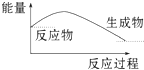 Ba(OH)2•8H2O 晶体和 NH4Cl 晶体反应能量变化如图所示 |
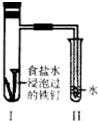
| A. | 过一段时间,Ⅱ试管中的导管内水柱上升 | |
| B. | Ⅰ试管中铁钉由于发生电解反应而被腐蚀 | |
| C. | 铁钉在该试管中的腐蚀速度越来越快 | |
| D. | Ⅰ试管中铁钉发生反应的一个电极方程式为:2Cl--2e-=Cl2↑ |
| A. | 葡萄糖和福尔马林与新制氢氧化铜悬浊液共热,都产生砖红色沉淀 | |
| B. | 将乙酸铅、硫酸铵溶液分别加入鸡蛋白溶液中,都产生白色沉淀 | |
| C. | 在苯、已烯中加入溴水振荡静置后,溴水层的颜色均变浅或褪去 | |
| D. | 乙酸钠、苯酚钠、乙醇钠溶液均能使酚酞溶液变红 |
| A. | CH2=CH2与CH2=CH-CH=CH2 | B. | CH≡CH与 CH3-CH2-C≡CH | ||
| C. | CH3OH与CH3CH2OH | D. |  与 与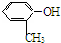 |
| A. | 用海水淡化后的浓缩海水作原料提取溴 | |
| B. | 在太阳能资源相对充足的沿海地区建造海水淡化厂 | |
| C. | 利用“海水→氯化钠→金属钠→氢氧化钠”的工艺流程生产烧碱 | |
| D. | 利用“海水→氢氧化镁→氯化镁→金属镁”的工艺流程生产金属镁 |
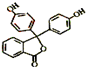 从其结构上看,酚酞属于酚或酯类衍生物,
从其结构上看,酚酞属于酚或酯类衍生物,