题目内容
【题目】某兴趣小组的同学对一批铁的样品(含有杂质,杂质不溶于水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行实验,其中一位同学所用的稀硫酸与铁样品恰好完全反应,实验数据如下表:
甲 | 乙 | 丙 | |
烧杯+稀硫酸的质量/g | 200 | 150 | 150 |
加入铁的样品的质量/g | 9 | 9 | 14 |
充分反应后,烧杯+剩余物的质量/g | 208.7 | 158.7 | 163.7 |
请你认真分析数据,回答下列问题:
(1)哪位同学所用的稀硫酸与铁的样品恰好完全反应_____?
(2)计算铁的样品中铁的质量分数_____。
【答案】乙 93.3%
【解析】
(1)根据化学反应方程式计算时,如果已知二种反应物的量,计算关键在于确定过量,以不足量物质进计行算。从乙→甲,铁的质量相同,酸增多,气体都是0.3 g,说明甲中盐酸有剩余,乙中铁已完全反应;从乙→丙,铁的质量增加,气体都是0.3 g,说明乙中盐酸已消耗完,丙中合金一定过量。综合可知乙同学实验中,铁和硫酸恰好完全反应;
(2)乙同学实验中产生氢气的质量为150 g+9g-158.7 g=0.3g
设参加反应的铁的质量为x
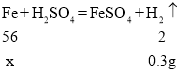
56:2=x:0.3 g
解得:x=8.4 g;
所以铁的样品中铁的质量分数为![]() ×100%≈93.3%。
×100%≈93.3%。

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目