题目内容
5.下列离子方程式书写不正确的是( )| A. | 少量铁粉加入稀硝酸中:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| B. | Ca(HCO3)2溶液与过量Ca(OH)2溶液反应:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | NH4HCO3溶液和过量Ba(OH)2溶液共热:2HCO3-+2OH-+Ba2+═BaCO3↓+CO32-+2H2O | |
| D. | Na2S溶液中通入足量H2S:S2-+H2S═2HS- |
分析 A.铁粉少量,铁与稀硝酸反应生成硝酸铁、NO气体和水,不是生成亚铁离子;
B.氢氧化钙过量,反应生成碳酸钙沉淀和水;
C.氢氧化钡过量,反应生成碳酸钡沉淀、一水合氨和水,碳酸根离子不会剩余;
D.硫化钠与硫化氢反应生成硫氢化钠.
解答 解:A.少量铁粉加入稀硝酸中,反应生成硝酸铁、一氧化氮气体和水,正确的离子方程式为:Fe+4H++NO3-═Fe3++NO↑+2H2O,故A错误;
B.Ca(HCO3)2溶液与过量Ca(OH)2溶液反应生成碳酸钙和水,反应的离子方程式为:Ca2++HCO3-+OH-═CaCO3↓+H2O,故B正确;
C.NH4HCO3溶液与足量Ba(OH)2溶液混合加热,反应生成氨气、碳酸钡沉淀和水,正确的离子反应为:HCO3-+NH4++Ba2++2OH- $\frac{\underline{\;\;△\;\;}}{\;}$BaCO3↓+NH3↑+2H2O,故C错误;
D.硫化钠溶液中通入足量H2S,反应生成硫氢化钠,反应的离子方程式为:S2-+H2S═2HS-,故D正确;
故选AC.
点评 本题考查了离子方程式的判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式等,本题侧重考查反应物过量情况对生成物的影响.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
6.将金属a放入b(NO3)2溶液发生如下反应:a+b2+═a2++b,则下列说法正确的是( )
| A. | 常温下,a或b可以与水发生反应 | |
| B. | a与b用导线连接插入H2SO4中,则形成原电池且b极上有H2放出 | |
| C. | a与b用导线连接插入b(NO3)2中一定构成原电池 | |
| D. | 用惰性电极电解a(NO3)2与b(NO3)2的混合液,在阳极先析出b |
10.下列反应的离子方程式正确的是( )
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | 用氯化铁溶液腐蚀电路板:Fe3++Cu═Fe2++Cu2+ |
17.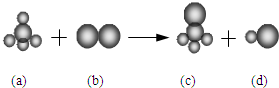 已知由三种元素构成的四种物质存在下列反应,其中a的分子空间构型为正四面体.组成a分子的两种元素的原子序数和小于10,组成b分子的元素为第三周期的元素.则下列判断正确的是( )
已知由三种元素构成的四种物质存在下列反应,其中a的分子空间构型为正四面体.组成a分子的两种元素的原子序数和小于10,组成b分子的元素为第三周期的元素.则下列判断正确的是( )
 已知由三种元素构成的四种物质存在下列反应,其中a的分子空间构型为正四面体.组成a分子的两种元素的原子序数和小于10,组成b分子的元素为第三周期的元素.则下列判断正确的是( )
已知由三种元素构成的四种物质存在下列反应,其中a的分子空间构型为正四面体.组成a分子的两种元素的原子序数和小于10,组成b分子的元素为第三周期的元素.则下列判断正确的是( )| A. | 四种分子中的化学键均是极性键 | B. | a、c分子中中心原子均为sp3杂化 | ||
| C. | 四种分子中既有σ键,又有π键 | D. | b、d分子中共价键的键能b大于d |
14.已知维生素A的结构简式如下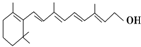 ,关于它的正确说法是( )
,关于它的正确说法是( )
 ,关于它的正确说法是( )
,关于它的正确说法是( )| A. | 维生素A分子式为C20H30O | |
| B. | 维生素A是一种易溶于水的醇 | |
| C. | 维生素A不易被氧化 | |
| D. | 1 mol维生素A最多可以和6 mol氢气加成 |
15.下列实验没有错误的是( )
| A. | 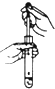 向试管中滴加液体 | B. | 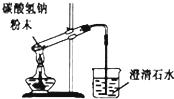 碳酸氢钠受热分解 | ||
| C. | 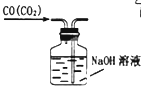 除去CO气体中的CO2气体 | D. | 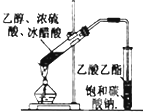 乙酸乙酯的制备 |