题目内容
17.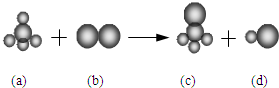 已知由三种元素构成的四种物质存在下列反应,其中a的分子空间构型为正四面体.组成a分子的两种元素的原子序数和小于10,组成b分子的元素为第三周期的元素.则下列判断正确的是( )
已知由三种元素构成的四种物质存在下列反应,其中a的分子空间构型为正四面体.组成a分子的两种元素的原子序数和小于10,组成b分子的元素为第三周期的元素.则下列判断正确的是( )| A. | 四种分子中的化学键均是极性键 | B. | a、c分子中中心原子均为sp3杂化 | ||
| C. | 四种分子中既有σ键,又有π键 | D. | b、d分子中共价键的键能b大于d |
分析 a的分子空间构型为正四面体.组成a分子的两种元素的原子序数和小于10,所以a是甲烷分子,组成b分子的元素为第三周期的元素形成双原子分子是氯气分子,所以反应是a甲烷与b氯气反应生成c是一氯甲烷和d是氯化氢,由此分析解答.
解答 解:A、b是氯与氯形成的非极性共价键,故A错误;
B、甲烷中碳与氢形成4个碳氢σ、一氯甲烷分子中形成三个碳氢σ和一个碳氯σ,中心原子均为sp3杂化,故B正确;
C、四种分子都无π键,故C错误;
D、氯的原子半径大于氢原子半径,所以氯气分子中的氯氯键的键能小于氯化氢分子中的氢氯键共价键的键能,故D错误;
故选B.
点评 本题是物质结构的综合性题目,涉及结构性质越位置关系、杂化理论、分子结构等,难度中等,是对学生综合能力的考查.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
17.有一未知浓度的盐酸25mL,在加入5mol•L-1AgNO3溶液25mL后,改加NaOH溶液,结果用去1.0mol•L-1 NaOH溶液25mL恰好完全中和,则此盐酸的物质的量浓度为( )( )
| A. | 0.5mol•L-1 | B. | 2.0mol•L-1 | C. | 1.5 mol•L-1 | D. | 1.0mol•L-1 |
18.NA 表示阿伏加德罗常数的值,则下列说法正确的是( )
| A. | 标况下,17g OH-所含的电子数为9NA | |
| B. | 28g 乙烯(C2H4 )和环丁烷(C4H8 )的混合气体中含有的碳原子数为NA | |
| C. | 常温常压下,44g CO2 中含有NA 个CO2 分子 | |
| D. | 等物质的量的N2和CO所含分子数均为NA |
5.下列离子方程式书写不正确的是( )
| A. | 少量铁粉加入稀硝酸中:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| B. | Ca(HCO3)2溶液与过量Ca(OH)2溶液反应:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | NH4HCO3溶液和过量Ba(OH)2溶液共热:2HCO3-+2OH-+Ba2+═BaCO3↓+CO32-+2H2O | |
| D. | Na2S溶液中通入足量H2S:S2-+H2S═2HS- |
12.以下物质间的转化通过一步反应不能实现的是( )
| A. | HCl→Cl2→HClO→NaClO | B. | Na→Na2O2→Na2CO3→NaHCO3 | ||
| C. | Mg→MgO→Mg(OH)2→MgCl2 | D. | Na→NaOH→NaHCO3→Na2CO3 |
2.已知C(s)+CO2(g)$\stackrel{△}{?}$2CO(g)正反应为吸热反应,下列措施能使正反应速率加快的是( )
①增加少量C(s) ②升高温度 ③容器不变,再通入CO2 ④缩小体积增大压强.
①增加少量C(s) ②升高温度 ③容器不变,再通入CO2 ④缩小体积增大压强.
| A. | ①②③ | B. | ①②③④ | C. | ②③ | D. | ②③④ |
9.下列对有机物结构或性质的描述中正确的是( )
| A. | 乙烷和丙烯的混合物共1mol,完成燃烧后不能确定生成的水的物质的量 | |
| B. | 等质量的乙炔和苯乙烯,完成燃烧后不能确定耗氧量是否相同 | |
| C. | 间二溴苯仅有一种空间结构,不能说明苯中不存在单双键交替的结构 | |
| D. | 用氢氧化钠溶液不能区别植物油和矿物油 |
6.已知拆开1mol C-H键需要吸收413kJ的能量.通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.下表列出了一些化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热.
试根据以上信息并结合已学知识判断下列说法中正确的是( )
| 化学键 | Cl-Cl | H-H | H-Cl | C-Cl | C-F | Si-Si | Si-O |
| 键能/kJ.mol-1 | 243 | 436 | 432 | 330 | 427 | 176 | 460 |
| A. | CCl4的稳定性小于CF4的稳定性 | |
| B. | CH4(g)跟Cl2(g)反应生成HCl(g)和CCl4(g)的反应是吸热反应 | |
| C. | 晶体硅的熔点低于SiO2 | |
| D. | 4 g H2和足量Cl2反应放出的热量为370 kJ/mol |
7.R原子序数是15,下列关于R元素的说法中,错误的是( )
| A. | R是第三周期第ⅤA族的元素 | |
| B. | R的最高正化合价是+5 | |
| C. | R的氢化物分子式是RH5 | |
| D. | R的最高价氧化物的水化物的水溶液呈酸性 |