题目内容
15.下面有关Na2CO3与NaHCO3的性质比较中错误的是( )| A. | 相同浓度溶液的碱性Na2CO3>NaHCO3 | |
| B. | 与同浓度的硫酸溶液反应放出气泡的速率NaHCO3<Na2CO3 | |
| C. | 在水中的溶解度Na2CO3>NaHCO3 | |
| D. | 热稳定性NaHCO3<Na2CO3 |
分析 A.CO32-以第一步水解为主,碳酸根离子的水解程度大于碳酸氢根离子的水解程度;
B.相同条件下NaHCO3比Na2CO3反应放出气体剧烈;
C.Na2CO3比NaHCO3易溶于水;
D.NaHCO3不稳定,加热易分解.
解答 解:A.CO32-以第一步水解为主,则Na2CO3溶液的碱性较强,故A正确;
B.分别滴加HCl溶液,反应离子方程式为CO32-+2H+═CO2↑+H2O,HCO3-+H+═H2O+CO2↑,相同条件下NaHCO3比Na2CO3反应放出气体剧烈,故B错误;
C.在饱和Na2CO3溶液中通入过量二氧化碳气体可得到NaHCO3沉淀,说明Na2CO3比NaHCO3易溶于水,故C正确;
D.NaHCO3不稳定,加热易分解:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,碳酸钠受热不易分解,较稳定,故D正确;
故选B.
点评 本题考查Na2CO3和NaHCO3性质的异同,题目难度不大,注意把握Na2CO3和NaHCO3性质,注重基础知识的积累.

练习册系列答案
相关题目
5.有硫酸钾和硫酸铝的混合溶液,已知其中Al3+物质的量浓度为0.4mol•L-1,SO42-的物质的量浓度为0.7mol•L-1,则此溶液中K+的物质的量浓度为( )
| A. | 0.1mol•L-1 | B. | 0.15mol•L-1 | C. | 0.2mol•L-1 | D. | 0.25mol•L-1 |
6.据最近报道,某放射性元素的原子钬16667Ho,可有效地治疗肝癌.该同位素原子核内中子数和核外电子数之差为( )
| A. | 32 | B. | 67 | C. | 99 | D. | 166 |
20.下列各组物质,按化合物、单质、混合物顺序排列的是( )
| A. | Fe(OH)3胶体、白磷、石灰乳 | B. | 干冰、铁、氯化氢 | ||
| C. | 烧碱、液态氧、碘酒 | D. | 空气、氮气、明矾 |
7.如图所示,下列叙述正确的是( )
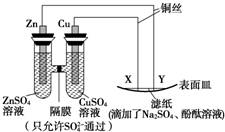

| A. | Y为负极,发生氧化反应 | B. | X为阴极,发生还原反应 | ||
| C. | Y与滤纸接触处变红 | D. | X与滤纸接触处有H2生成 |
4.下列说法中,正确的是( )
| A. | 分解反应一定是氧化还原反应 | |
| B. | 非金属单质在化学反应中一定是氧化剂 | |
| C. | 金属单质在化学反应中一定是还原剂 | |
| D. | 元素由化合态转化为游离态,该元素一定被还原 |
5.下列各组内的两种物质互为同素异形体的是( )
| A. | 16O和18O | B. | O2和O3 | C. | 乙烷和丙烷 | D. | 乙酸和甲酸甲酯 |
 如图是钢铁在潮湿空气里发生电化学腐蚀原理示意图,发生的反应为:
如图是钢铁在潮湿空气里发生电化学腐蚀原理示意图,发生的反应为: