题目内容
【题目】(1)在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
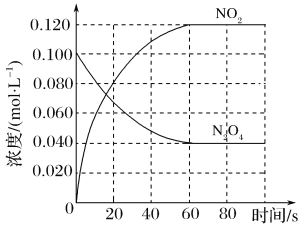
该反应ΔH______0(填“>”、“<”或“=”),在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1。平衡常数K=________________(请书写单位)。在温度不变的情况下向平衡体系中再充入N2O4 0.01mol·L-1和NO20.03mol·L-1此时v(正)___________v(逆)(填“>”、“<”或“=”)。有利于提高反应N2O4(g) ![]() 2NO2(g)平衡转化率的条件是________(填标号)。
2NO2(g)平衡转化率的条件是________(填标号)。
A.高温低压 B.低温高压
C.高温高压 D.低温低压
(2)在一定温度下,向a L密闭容器中加入1 molN2O4(g)发生如下反应:N2O4(g) ![]() 2NO2(g),不能说明该反应一定达平衡的是__________。
2NO2(g),不能说明该反应一定达平衡的是__________。
A.容器内压强不随时间变化
B.容器内各物质的浓度不随时间变化
C.容器内O2、NO、NO2的浓度之比为1:2:2
D.单位时间内生成1 mol N2O4(g),同时生成2 mol NO2
E.混合气体的密度不随时间变化
F.混合气体的颜色不随时间变化
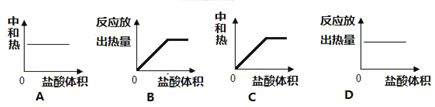
(3)在体积都为1 L,pH都等于2的盐酸和醋酸溶液中,投入0.65 g锌粒,则如图所示符合客观事实的是__________
A. 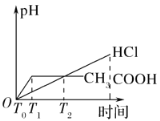 B.
B. 
C. 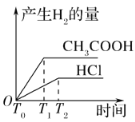 D.
D. 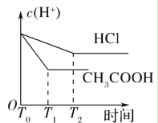
(4)25 ℃时,一元弱酸HA溶液Kal=4.3×10-4 ,一元弱酸HB溶液Ka2=5.6×10-4则酸性HA____________HB(填“>”、“<”或“=”)。
(5)常温下0.001mol·L-1的H2SO4溶液与0.004mol·L-1的NaOH溶液1:1体积比混合,混合后溶液的pH=_____________。
【答案】> 0.0010 0.36mol·L-1 < A CE C < 11
【解析】
(1)由温度对平衡的影响可知![]() 的反应的吸放热类型;计算反应速率和平衡常数时结合具体公式再利用图中给出的数据计算即可;在向平衡后的容器中通入一定量的N2O4和NO2后,可根据浓度商与平衡常数的大小关系判断反应平衡的移动方向;利用平衡移动原理可判断提高上述反应转化率的方法;
的反应的吸放热类型;计算反应速率和平衡常数时结合具体公式再利用图中给出的数据计算即可;在向平衡后的容器中通入一定量的N2O4和NO2后,可根据浓度商与平衡常数的大小关系判断反应平衡的移动方向;利用平衡移动原理可判断提高上述反应转化率的方法;
(2)判断反应![]() 是否平衡可根据平衡状态的特点进行分析,此题额外要注意审题,需要从中筛选出不能判断可逆反应处于平衡状态的选项;
是否平衡可根据平衡状态的特点进行分析,此题额外要注意审题,需要从中筛选出不能判断可逆反应处于平衡状态的选项;
(3)四个图像分别描述的是盐酸和醋酸两种溶液在加入一定量的锌粒后pH值,氢气产生速率,氢气产量以及溶液中氢离子浓度的变化规律;分析时,注意两种酸强弱不同,但初始的pH以及体积相同,此外,加入的锌粒为0.65g;
(4)比较两种一元酸的强弱,可根据相同条件下电离平衡常数的大小进行判断;
(5)计算酸与碱溶液混合后的溶液的pH,要先考虑发生中和反应,再根据反应后剩余酸或碱的量进行计算。
(1)NO2有颜色,而N2O4气体无颜色;因此升温后,混合气体颜色变深表明可逆反应![]() 正向移动;因此该反应是吸热反应
正向移动;因此该反应是吸热反应![]() ;由图可知,0~60s内,N2O4浓度下降了0.060mol/L,因此反应速率为:
;由图可知,0~60s内,N2O4浓度下降了0.060mol/L,因此反应速率为:![]() ;由图可知,平衡时NO2浓度为0.120mol/L,N2O4浓度为0.040mol/L,因此平衡常数为:
;由图可知,平衡时NO2浓度为0.120mol/L,N2O4浓度为0.040mol/L,因此平衡常数为: ;当达到平衡后,再通入0.01mol/L的N2O4和0.03mol/L的NO2后,此时容器内N2O4浓度为0.05mol/L,NO2浓度为0.15mol/L,那么浓度商为:
;当达到平衡后,再通入0.01mol/L的N2O4和0.03mol/L的NO2后,此时容器内N2O4浓度为0.05mol/L,NO2浓度为0.15mol/L,那么浓度商为: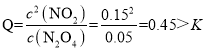 ,故平衡逆向移动,那么v逆>v正;由于
,故平衡逆向移动,那么v逆>v正;由于![]() 是吸热反应,为了获得更高的转化率需要在较高温度下进行,同时降低压强也有利于反应正向进行,因此高温低压的条件有利于获得更高的转化率,A项正确;
是吸热反应,为了获得更高的转化率需要在较高温度下进行,同时降低压强也有利于反应正向进行,因此高温低压的条件有利于获得更高的转化率,A项正确;
(2)A.由于该反应是非等体积反应,并且是在恒温恒容的容器中进行,根据![]() 可知,若容器内压强不再变化,那么容器内气体的总量一定不再变化,那么反应一定处于平衡状态,A项能说明;
可知,若容器内压强不再变化,那么容器内气体的总量一定不再变化,那么反应一定处于平衡状态,A项能说明;
B.当容器内物质的浓度不变时,根据平衡状态的特点可知,可逆反应一定处于平衡状态,B项能说明;
C.由于并不明确容器内上述三种物质的浓度之比是否还会发生改变,因此C项的描述不能证明可逆反应一定处于平衡状态,故C项不能说明;
D.生成NO2的速率描述的是正反应的速率,生成N2O4的速率描述的是逆反应的速率,由于二者生成速率之比即为相应的化学计量系数比,所以此时正逆反应速率相等,可逆反应一定处于平衡状态,D项能说明;
E.由于该反应是在恒温恒容条件下进行的,根据![]() 可知,此时气体的密度是定值,与是否平衡无关,因此密度不变可逆反应不一定平衡,E项不能说明;
可知,此时气体的密度是定值,与是否平衡无关,因此密度不变可逆反应不一定平衡,E项不能说明;
F.NO2有颜色,而N2O4气体无颜色,当混合气体颜色不变时,说明NO2浓度不再改变,可逆反应一定处于平衡状态,F项能说明;综上所述,CE项不能说明反应处于平衡状态;
答案选CE;
(3)醋酸是弱酸,盐酸是强酸,常温下二者均为pH=2时,盐酸的浓度为0.01mol/L,而醋酸的浓度要明显大于0.01mol/L;因此二者体积均为1L时,对于盐酸而言0.65g锌显然是过量的,因此二者在与锌反应时,最终醋酸生成的氢气会更多;盐酸与醋酸初始pH相等,由于醋酸弱电离的原因,导致其相比于盐酸,氢离子浓度下降的更慢即pH变化的更为缓慢;又因为氢离子浓度越大时,酸与金属反应生成氢气的速率越快,因此反应开始后,醋酸生成氢气的速率要比盐酸更快;
A.通过分析可知,由于醋酸是弱酸,溶液中存在醋酸的电离平衡,这就导致其与锌发生反应时,相比于盐酸,氢离子浓度下降的较慢,那么pH变化的也就更为平缓,故A图不符;
B.通过分析可知,由于反应开始后盐酸中氢离子浓度下降较快,导致其氢离子浓度相比于醋酸更低,因此在与锌反应时反应速率更低,故B图不符;
C.通过分析可知,pH=2时,盐酸浓度仅为0.01mol/L,醋酸浓度明显大于0.01mol/L,体积均为1L时,二者均与0.65g锌反应,醋酸会以更快的反应速率生成更多的氢气,故C图符合;
D.通过分析可知,由于醋酸溶液中存在醋酸的电离平衡,使得其氢离子浓度下降的更为缓慢,故D图不符;
答案选C;
(4)由于相同温度下,HA的电离常数小于HB的,因此,HA的酸性弱于HB的;
(5)为便于计算,不妨假设硫酸与NaOH溶液的体积均为1L;二者混合后发生中和反应,由于NaOH溶液的浓度为0.004mol/L,而硫酸的浓度为0.001mol/L,因此反应后NaOH仍有剩余,剩余的NaOH的物质的量为:![]() ;混合后总体积为2L,所以混合后溶液中OH-浓度为0.001mol/L,那么溶液中H+浓度为10-11mol/L,溶液的pH=11。
;混合后总体积为2L,所以混合后溶液中OH-浓度为0.001mol/L,那么溶液中H+浓度为10-11mol/L,溶液的pH=11。