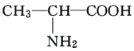
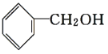
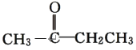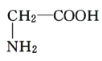题目内容
【题目】已知反应A2(?)+2B2(g) ![]() 2AB2(g) ΔH,在其他条件不变,改变某一条件时得到如下图象,下列对应图象叙述不正确的是
2AB2(g) ΔH,在其他条件不变,改变某一条件时得到如下图象,下列对应图象叙述不正确的是
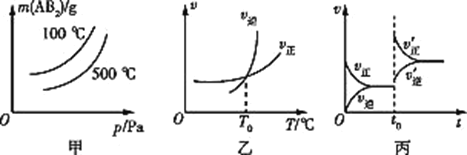
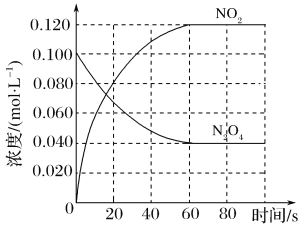
A.由图甲可知,A2为气体
B.由图甲可知,ΔH<0
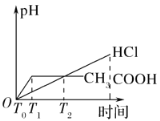
C.由图乙可知,T=T0 ℃时,该可逆反应达到平衡状态
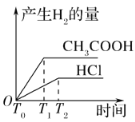
D.由图丙可知,t=t0时,改变的条件可能是增加了B2的量
【答案】D
【解析】
A.由甲图可以看出,改变压强后产物的质量改变,因此本反应一定是前后气体分子数不相等的反应,则![]() 一定是气体,A项正确;
一定是气体,A项正确;
B.由甲图可以看出,当压强一致时,温度越高产物的质量越小,因此正反应是放热的,B项正确;
C.当正逆反应速率相等时,反应即达到平衡状态,C项正确;
D.![]() 是反应物,若增加反应物的物质的量,逆反应速率不可能瞬间增加,D项错误;
是反应物,若增加反应物的物质的量,逆反应速率不可能瞬间增加,D项错误;
答案选D。

练习册系列答案
 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
【题目】下列实验操作、现象与结论均正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 25℃,两片相同的Al片分别和等体积的稀HNO3和浓HNO3反应 | 前者产生无色气体,后者产生红棕色气体,且后者反应更加剧烈 | 其他条件相同时,反应物浓度越大,反应速率越快 |
B | 往黄色固体难溶物PbI2中加水,振荡,静置。取上层清液,然后加入NaI固体 | 产生黄色沉淀 | 难溶物PbI2存在沉淀溶解平衡 |
C | 向蛋白质溶液中分别加入乙醇溶液和(NH4)2SO4饱和溶液 | 均产生白色沉淀 | 蛋白质均发生了变性 |
D | 向稀硫酸中加入铜片,然后通入氧气加热 | 开始无明显现象,通入氧气加热后溶液变蓝 | 氧化性:稀硫酸> Cu2+ |
A. A B. B C. C D. D