题目内容
【题目】Ⅰ:二氧化碳的回收利用是环保领域研究的热点课题。
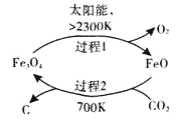
(1)以CO2为原料制取炭黑的流程如图所其总反应的化学方程式为________,
(2)CO2经过催化氢化合成低碳烯烃。其合成乙烯的反应为2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) ΔH几种物质的能量(在标准状况下,规定单质的能量为 0,测得其他物质在生成时所放出或吸收的热量)如下表所示:
CH2=CH2(g)+4H2O(g) ΔH几种物质的能量(在标准状况下,规定单质的能量为 0,测得其他物质在生成时所放出或吸收的热量)如下表所示:
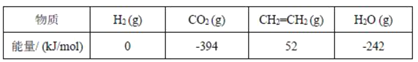
则ΔH=____。
Ⅱ:已知:①2C(s)+O2(g)=2CO(g) ΔH=-220kJ·mol-1;②氢气燃烧的能量变化示意图:
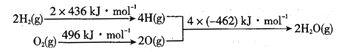
请写出碳和水蒸气反应,生成 CO和H2的热化学方程式:_______
Ⅲ:向100mL0.1mol·L-1 稀 NaOH溶液中加入稀盐酸,“中和热”或“反应放出热量”与所加入的盐酸体积的关系图正确的是(________)
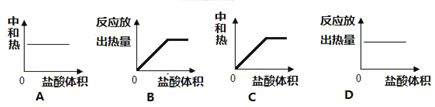
【答案】CO2![]() C+O2 -128kJ/mol C(s)+H2O(g)=CO(g)+H2(g) △H=+130kJ/mol AB
C+O2 -128kJ/mol C(s)+H2O(g)=CO(g)+H2(g) △H=+130kJ/mol AB
【解析】
I.(1)在700K条件下,CO2和FeO发生反应生成C和Fe3O4,过程1中Fe3O4分解生成FeO和O2,所以整个反应过程中FeO作催化剂,根据反应物和生成物及反应条件书写方程式;
(2)焓变等于生成物总能量减去反应物总能量;
II.根据盖斯定律,睛已知的热化学方程式叠加,可得待求反应的热化学方程式;
III.中和热是强酸强碱发生中和反应产生1mol水时放出的热量;反应放出的热量与反应的物质的多少有关。
(1)在700K条件下,CO2和FeO发生反应生成C和Fe3O4,过程1中Fe3O4分解生成FeO和O2,所以整个反应过程中FeO作催化剂,根据反应物和生成物及反应条件书写方程式为CO2![]() C+O2;
C+O2;
(2)焓变等于生成物总能量减去反应物总能量,则该反应的焓变=[52+(-242)×4-(-392)×2-0]kJ/mol=-128kJ/mol;
II.①2C(s)+O2(g)=2CO(g) ΔH=-220kJ·mol-1;②根据图示可得H2(g)+![]() O2(g)=H2O(g) ΔH=436kJmol+
O2(g)=H2O(g) ΔH=436kJmol+![]() kJ/mol -2(-462)kJ/mol=-240kJ/mol;根据盖斯定律将
kJ/mol -2(-462)kJ/mol=-240kJ/mol;根据盖斯定律将![]() ①-②,整理可得C(s)+H2O(g)=CO(g)+H2(g) △H=+130kJ/mol;
①-②,整理可得C(s)+H2O(g)=CO(g)+H2(g) △H=+130kJ/mol;
III.中和热是强酸强碱发生中和反应产生1mol水时放出的热量,由于水的物质的量是1mol,所以中和热不会发生变化,是一个定值,选项A正确,C错误;
在容器中含有的NaOH的物质的一定,随着HCl的加入,反应产生的H2O的物质的量逐渐增多,反应放出的热量也逐渐增多,当NaOH恰好反应完全时,放出的热量达到最大值,此后再加入盐酸,不能在反应,反应放出的热量也不再发生变化,则选项B正确、D错误;
所以合理选项是AB。