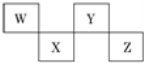
题目内容
【题目】MnSO4晶体是一种易溶于水的微红色晶体,某校同学设计实验制备并检验MnSO4的性质。回答下列问题:
(1)甲组同学设计用SO2和适量纯净的MnO2制备MnSO4,其装置如下:
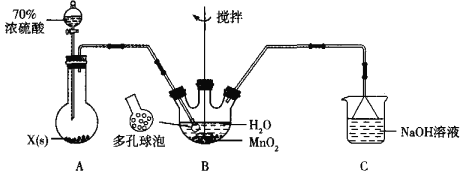
①A装置中固体药品X通常是______填化学式)。
②B装置中通SO2的导管末端接多孔球泡的目的是______;C装置用于吸收少量的SO2,发生反应的离子方程式为______。
(2)乙组同学定性检验甲组同学的产品中Mn2+的存在,取少量晶体溶于水,加入(NH4)2S2O8溶液,滴入硝酸银(作催化剂),微热振荡,溶液显紫色,发生反应的离子方程式为______。
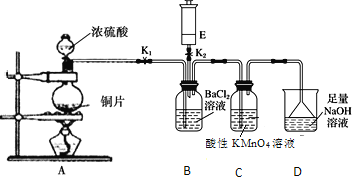
(3)丙组同学为检验无水MnSO4(接近白色)的热分解产物,将MnSO4晶体脱水后放入下图所示的装置中,打开K1和K2,缓慢通入N2,加热,硬质玻璃管中最后得到黑色固体。
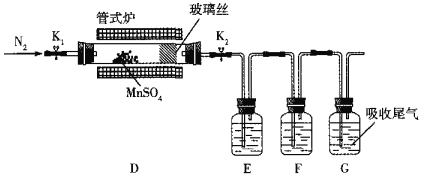
①检验分解的气态产物中是否有SO2及SO3,装置E、F中的溶液依次是______、______(填字母)。
a.Ba(NO3)2溶液b.BaCl2溶液c.品红溶液d.浓硫酸
②若D中得到的黑色粉末为Mn3O4,E、F中均有明显现象,则D中发生反应的化学方程式为______。
(4)丁组同学设计实验以丙组同学得到的黑色粉末为原料,利用铝热反应原理将其还原为金属锰,所需的药品除氯酸钾外,还需要______。
【答案】Na2SO3 增大SO2与液体的接触面积 SO2+2OH-=SO32-+H2O 2Mn2++5S2O82-+8H2O 2MnO4-+10SO42-+16H+ b c 3MnSO4
2MnO4-+10SO42-+16H+ b c 3MnSO4![]() Mn3O4+SO2↑+2SO3↑ 铝粉、镁条
Mn3O4+SO2↑+2SO3↑ 铝粉、镁条
【解析】
(1)①A装置制备二氧化硫气体,实验室一般用亚硫酸盐与浓硫酸制备,固体药品X通常是Na2SO3,故答案为:Na2SO3;
②B装置中通SO2的导管末端接多孔球泡的目的是增大SO2与液体的接触面积;C装置用于吸收少量的SO2,反应为:SO2+2OH-=SO32-+H2O,故答案为:增大SO2与液体的接触面积;SO2+2OH-=SO32-+H2O;
(2)根据题意,Mn2+与(NH4)2S2O8溶液在硝酸银作催化剂,微热振荡反应,溶液显紫色,说明生成高锰酸跟离子,锰元素化合价升高,则硫元素化合价降低生成硫酸根离子,故反应为:2Mn2++5S2O82-+8H2O![]() 2MnO4-+10SO42-+16H+,故答案为:2Mn2++5S2O82-+8H2O
2MnO4-+10SO42-+16H+,故答案为:2Mn2++5S2O82-+8H2O![]() 2MnO4-+10SO42-+16H+;
2MnO4-+10SO42-+16H+;
(3)①检验分解的气态产物中是否有SO2及SO3,检验三氧化硫时,为防止二氧化硫的干扰,用氯化钡溶液检验,二氧化硫用品红溶液检验,装置E、F中的溶液依次是BaCl2溶液,品红溶液,故答案为:b;c;
②D中得到的黑色粉末为Mn3O4,E、F中均有明显现象,说明生成SO2及SO3,反应为:3MnSO4![]() Mn3O4+SO2↑+2SO3↑,故答案为:3MnSO4
Mn3O4+SO2↑+2SO3↑,故答案为:3MnSO4![]() Mn3O4+SO2↑+2SO3↑;
Mn3O4+SO2↑+2SO3↑;
(4)利用铝热反应原理将其还原为金属锰,所需的药品有铝粉,氯酸钾作供氧剂,还需要点燃的镁条提供高温条件,故答案为:铝粉、镁条。

 阅读快车系列答案
阅读快车系列答案【题目】室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 向苯酚钠溶液中滴加NaHSO3溶液,溶液变浑浊 | 苯酚酸性弱于H2SO3酸性 |
B | 向AgNO3溶液中逐滴加入浓度均为0.05 mol·L-1的NaI、NaCl混合溶液,有黄色沉淀生成 | Ksp(AgCl)>Ksp(AgI) |
C | 向FeCl3溶液中加入Cu粉,Cu粉溶解 | Cu的还原性大于Fe |
D | 向盛有H2O2溶液的试管中滴几滴酸化的FeCl2溶液,溶液变成棕黄色,一段时间后,溶液中有气泡出现 | 铁离子催化H2O2的分解 |
A.AB.BC.CD.D
【题目】PH3是粮食杀虫处理时常用的熏蒸杀虫剂;水煤气变换时产生的PH3能使催化剂中毒,必须脱除。回答下列问题:
(1)PH3通入NaClO溶液脱除PH3时,氧化产物是一种含氧酸且反应中氧化剂与还原剂的物质的量之比为4:1,则该含氧酸的化学式为______。
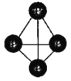
(2)已知下列键能数据及P4(白磷)分子结构:
化学键 | P-P | H-H | P-H |
|
键能/(kJmol-1) | 213 | 436 | 322 |
则反应4PH3(g)P4(g)+6H2(g)△H=______kJmol-1;某温度时平衡体系中c(PH3)=0.25molL-1,c(H2)=c(P4)=0.50molL-1,则平衡常数K=______。
(3)文献报道“反应6.25CO2(g)+Fe3O4(s)+3PH3(g)=3FePO4(s)+4.5H2O(g)+6.25C(s)”是铁触媒中毒的主导反应,其平衡常数Kp(Kp为以分压表示的平衡常数)的对数值与温度的关系如图所示:
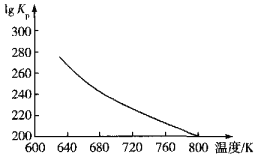
①该反应的△H______0(填“>”“<”或“=”)。
②图中lgKp=______[列出用分压p(CO2)、p(PH3)、p(H2O)表示的计算式]。
(4)反应(CH3)3AuPH3→(CH3)AuPH3+C2H6的历程如下:
第一步:(CH3)3AuPH3![]() (CH3)3Au+PH3(快反应)
(CH3)3Au+PH3(快反应)
第二步:(CH3)3Au![]() C2H6+CH3Au(慢反应)
C2H6+CH3Au(慢反应)
第三步:CH3Au+PH3![]() (CH3)AuPH3(快反应)
(CH3)AuPH3(快反应)
①反应的中间产物有PH3、______。
②第______步(填“一”“二”或“三”)反应的活化能最大。
(5)用Cu2+、Pd2+液相脱除PH3的反应为:PH3+2O2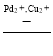 H3PO4,其他条件相同时溶解在溶液中O2的体积分数、PH3的净化效率与时间的关系如图所示:
H3PO4,其他条件相同时溶解在溶液中O2的体积分数、PH3的净化效率与时间的关系如图所示:
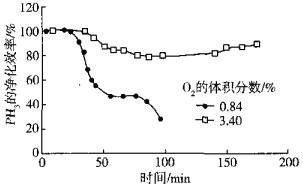
O2的体积分数大,PH3的净化效率高的原因是______(用碰撞理论等说明)。