题目内容
7.瘦肉精学名盐酸克伦特罗,其结构简式如图,有关瘦肉精的说法不正确的是( )
| A. | 化学式为C12H18ON2Cl2 | |
| B. | 可以发生取代、加成、水解、酯化、消去反应 | |
| C. | 属于芳香族化合物 | |
| D. | 遇FeCl3溶液发生显色反应 |
分析 由结构简式可知分子式,分子中含氨基、-Cl、醇-OH等,结合卤代烃、醇、氨基的性质来解答.
解答 解:A.由结构简式可知分子式为C12H18ONH2Cl2,故A正确;
B.含-Cl、-OH可发生取代,含苯环可发生加成,含-Cl可发生水解,含-OH可发生酯化、消去反应,故B正确;
C.分子中含苯环,为芳香族化合物,故C正确;
D.不含酚-OH,则不能遇FeCl3溶液发生显色反应,故D错误.
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重醇、卤代烃性质及相关概念的考查,注意酚与醇的区别,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.“西气东输”是我国为改善东部地区能源紧缺、开发大西北而实施的一项重大工程.这里的“气”是指( )
| A. | 氢气 | B. | 天然气 | C. | 一氧化碳 | D. | 水煤气 |
18.下列物质能用铝制器皿盛放的是( )
| A. | 稀硝酸 | B. | 稀硫酸 | C. | 浓硝酸 | D. | 浓盐酸 |
15.下列各组性质的比较中正确的是( )
| A. | 酸性:HClO4<HBrO4 | B. | 碱性强弱:NaOH>LiOH | ||
| C. | 稳定性:H2S>H2O | D. | 氧化性:I2>Br2>Cl2 |
2.一定量的铝与过量的稀盐酸反应时,为了加快反应速率,但又不影响生成的氢气总量,可以采取的措施是( )
| A. | 升高温度 | B. | 加入适量的水 | ||
| C. | 加入少量CuSO4溶液 | D. | 加入浓度较大的盐酸 |
12.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 在常温常压下,1 mol 氖气含有的原子数为2 NA | |
| B. | 1 mol Na2O2中含有O22-数目为NA | |
| C. | 1 mol/L的NaCl溶液中Na+数为NA | |
| D. | 在同温同压下,相同体积的任何气体单质所含的原子数相同 |
19.图所示装置中,已知电子由b极沿导线流向锌.下列判断正确的是( )
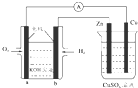

| A. | 该装置中Zn极为阳极 | |
| B. | 一段时间后铜片上质量增加 | |
| C. | a极反应的电极反应式为:O2+4e-+2H2O═4OH- | |
| D. | 当铜极的质量变化为32g时,b极上消耗的O2的体积为11.2 L |
16.通过下列方法测定1.80g金属Sn样品的纯度.
①将样品溶于盐酸:Sn+2HCl═SnCl2+H2↑;
②加过量FeCl3溶液:SnCl2+2FeCl3═SnCl4+2FeCl2;
③再用酸性KMnO4反应生成的Fe2+,用去0.1000mol/L的KMnO4溶液60.00mL,反应的离子方程式为:MnO4-+
5Fe2++8H+═Mn2++5Fe3++4H2O.
计算金属Sn样品的纯度为( )
①将样品溶于盐酸:Sn+2HCl═SnCl2+H2↑;
②加过量FeCl3溶液:SnCl2+2FeCl3═SnCl4+2FeCl2;
③再用酸性KMnO4反应生成的Fe2+,用去0.1000mol/L的KMnO4溶液60.00mL,反应的离子方程式为:MnO4-+
5Fe2++8H+═Mn2++5Fe3++4H2O.
计算金属Sn样品的纯度为( )
| A. | 99.2% | B. | 49.6% | C. | 96.2% | D. | 46.6% |
17.下列装置或操作能达到实验目的是( )
| A. |  验证反应的热效应 | B. |  定量测定化学反应速率 定量测定化学反应速率 | ||
| C. |  滴定法测FeSO4溶液的浓度 | D. | 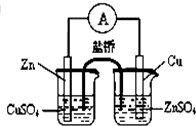 构成铜锌原电池 |