题目内容
5.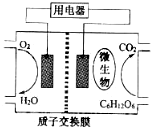 科学家近年来研制出一种新型细菌燃料电池.以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述正确的是( )
科学家近年来研制出一种新型细菌燃料电池.以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述正确的是( )| A. | 该电池的负极反应为O2+2H2O+4e-=4OH- | |
| B. | 电池的负极反应为:C6H12O6+6H2O=6CO2↑+24H++24e- | |
| C. | 放电过程中,H+从正极区向负极区迁移 | |
| D. | 在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体22.4L |
分析 A、负极发生氧化反应,葡萄糖失电子生成二氧化碳,电极反应为C6H12O6+6H2O-24e-═6CO2↑+24H+;
B、负极是葡萄糖失电子生成二氧化碳,电极反应为C6H12O6+6H2O-24e-═6CO2↑+24H+;
C、原电池内部阳离子应向正极移动,阴离子向负极移动;
D、由正负极电极反应式可知消耗1mol氧气生成1mol二氧化碳,进行计算.
解答 解:A、负极是葡萄糖失电子生成二氧化碳,电极反应为C6H12O6+6H2O-24e-═6CO2↑+24H+,故A错误;
B、负极是葡萄糖失电子生成二氧化碳,电极反应为C6H12O6+6H2O-24e-═6CO2↑+24H+,故B正确;
C、原电池内部阳离子应向正极移动,所以H+从负极区通过质子交换膜向正极区迁移,故C错误;
D、正极反应式为O2+4e-+4H+═2H2O,对比负极反应可知,消耗1mol氧气生成1mol二氧化碳,标准状况下体积是22.4L,故D正确;
故选:BD.
点评 本题考查了原电池原理、电极方程式的书写、离子的移动方向,有关化学方程式的计算,有关气体体积的计算要注意温度和压强,为易错点.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案
相关题目
15.下列实验能达到目的是( )
| A. | 用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸 | |
| B. | 用Cu与S共热制备CuS | |
| C. | 用品红和盐酸检验Na2SO3和Na2CO3 | |
| D. | 将混有乙烯的SO2通入酸性KMnO4溶液中除去乙烯 |
16.下列关于化学键和化合物的说法中正确的是( )
| A. | 化学键的形成一定伴随着电子的得失 | |
| B. | 金属元素和非金属元素形成的化合物一定是离子化合物 | |
| C. | 含有阴离子的化合物一定含有阳离子 | |
| D. | 非金属元素组成的化合物一定是共价化合物 |
13.蛋白质发生的下列反应中,可逆的是( )
| A. | 盐析 | B. | 变性 | C. | 煮熟 | D. | 加入硫酸钠 |
20.下列关于氯气的叙述中正确的是( )
| A. | 氯气是一种黄绿色、有毒的气体 | |
| B. | 氯气的密度比空气的小 | |
| C. | 氯气不能溶于水,可以用排水法收集 | |
| D. | 氯气、氯水和液氯是同一种物质 |
14.为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中可装入的物质是( )
| A. | 无水硫酸铜、蔗糖 | B. | 硅胶、硫酸亚铁 | C. | 食盐、硫酸亚铁 | D. | 生石灰、食盐 |


 .
. 结构且能水解的所有同分异构体的结构简式:
结构且能水解的所有同分异构体的结构简式: .
.
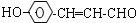 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$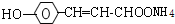 +2Ag↓+3NH3+H2O,反应类型为氧化反应
+2Ag↓+3NH3+H2O,反应类型为氧化反应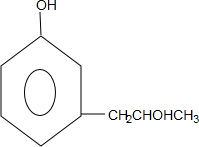 ,G的结构简式
,G的结构简式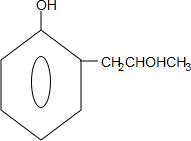 .
.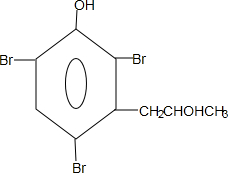 能够溶于有机物,不溶于水,所以在NaOH溶液中出现白色沉淀
能够溶于有机物,不溶于水,所以在NaOH溶液中出现白色沉淀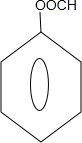 ,
,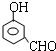 或
或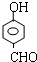 或
或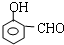 .
.