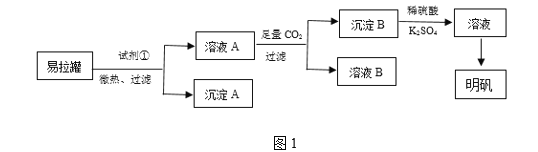
题目内容
【题目】某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。
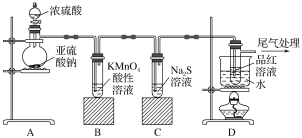
请回答下列问题:
(1)装置A中盛放浓硫酸的仪器名称是________,其中发生反应的化学方程式为_____。
(2)实验过程中,装置B、C中发生的现象分别是_____、 ____,这些现象分别说明SO2具有的性质是____和____。
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象_________。
(4)尾气可采用________溶液吸收。(写化学式)
【答案】分液漏斗 Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O 溶液由紫红色变为无色 出现黄色浑浊 还原性 氧化性 待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热;无色溶液恢复为红色 NaOH
【解析】
实验目的是探究SO2的性质,A装置为制气装置,B装置验证SO2的还原性,C装置验证SO2的氧化性,D装置验证SO2的漂白性,据此分析;
(1)A装置盛放浓硫酸的仪器是分液漏斗;根据所加药品,装置A为制气装置,化学反应方程式为Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(2)酸性高锰酸钾溶液显紫红色,具有强氧化性,如果颜色褪去,体现SO2的还原性,SO2和Na2S发生反应,生成硫单质,体现SO2的氧化性;答案是溶液紫红色褪去,出现黄色沉淀,还原性,氧化性;
(3)SO2能够使品红溶液褪色,体现SO2的漂白性,加热后,溶液恢复为红色,探究SO2与品红作用的可逆性,具体操作是待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热;无色溶液恢复为红色;
(4)SO2有毒气体,为防止污染环境,需要尾气处理,SO2属于酸性氧化物,采用碱液吸收,一般用NaOH溶液。

【题目】实验室用下列两种方法制取氯气:①用含HCl 146g的浓盐酸与足量的MnO2反应;②用87g MnO2与足量的浓盐酸反应,则所得Cl2质量
A. ①比②多B. ②比①多C. 一样多D. 无法比较
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g) 经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g) 经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A.反应在前50 s的平均速率为v (PCl3) = 0.0032 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时,c(PCl3) = 0.11 mol·L-1,则反应的ΔH < 0
C.相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,达到平衡前v (正) < v (逆)
D.相同温度下,起始时向容器中充入2.0 mol PCl5,达到平衡时PCl5的转化率小于20%