题目内容
【题目】明矾[KAl(SO4)2·12H2O]是一种复盐,在造纸等方面应用广泛。某兴趣小组采用10.0 g废易拉罐(含90%的Al,还含有少量的Fe、Mg等杂质)制备明矾的实验方案如图1:
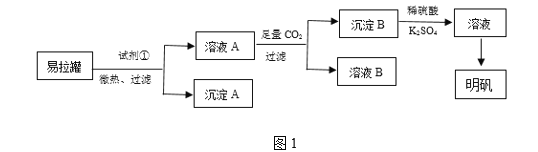
(1)试剂①应选用________(填代号)。
a.盐酸 b.H2SO4溶液 c.氨水 d.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为__________。通入足量二氧化碳发生的反应的离子方程式___________________________。
(3)沉淀B为_____(填化学式),溶液B中溶质的主要成分为________(填化学式)。
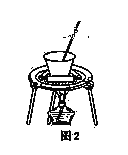
(4)从溶液C中得到明矾的实验操作步骤为蒸发浓缩、________(填操作名称)、过滤、洗涤、干燥。如图2所示,蒸发操作中的一处错误是______________。
(5)该小组在实验完成之后,得到118.5 g明矾,则明矾的回收率为________。(已知:明矾的摩尔质量为474 g·mol-1)
【答案】d 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ AlO2-+2H2O+CO2= Al(OH)3 ↓+HCO3- Al(OH)3 NaHCO3 冷却结晶 蒸发不能使用坩埚,应使用蒸发皿 75%
【解析】
易拉罐的主要成分为Al,含有少量的Fe、Mg杂质,可选择浓NaOH溶解,得到偏铝酸钠溶液(溶液A),并通过过滤除去Fe、Mg(沉淀A)等杂质,滤液中通入CO2溶液后,后生成氢氧化铝沉淀和碳酸氢钠,通过过滤得到碳酸氢钠溶液(溶B)和氢氧化铝(沉淀B),过滤后将沉淀溶解在稀硫酸中,得到硫酸铝溶液,添加K2SO4溶液后蒸发浓缩并冷却结晶得到晶体明矾,据此分析解答。
(1)根据铝能溶解在强酸和强碱性溶液,而铁和镁只能溶解在强酸性溶液中的性质差异,可选择NaOH溶液溶解易拉罐,可除去含有的铁、镁等杂质;
故答案为:d;
(2)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,发生反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑;通入足量二氧化碳发生的反应生成氢氧化铝和碳酸氢钠,离子方程式AlO2-+2H2O+CO2= Al(OH)3 ↓+HCO3-,
故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;AlO2-+2H2O+CO2= Al(OH)3 ↓+HCO3-;
(3)根据分析可知,偏铝酸钠溶液中通入CO2溶液后,后生成氢氧化铝沉淀和碳酸氢钠,通过过滤得到碳酸氢钠溶液(溶B)和氢氧化铝(沉淀B),溶液B为NaHCO3溶液;
故答案为:Al(OH)3;NaHCO3;
(4)硫酸铝溶液中添加K2SO4溶液后蒸发浓缩并冷却结晶、过滤、洗涤、干燥得到晶体明矾;蒸发不能使用坩埚;
故答案为:冷却结晶;蒸发不能使用坩埚;
(5)根据铝元素守恒,AlKAl(SO4)212H2O,理论上可得到明矾的质量为:![]() =158g,则明矾的回收率为
=158g,则明矾的回收率为![]() ×100%=75%;
×100%=75%;
故答案为:75%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】二氧化氯(ClO2)是世界卫生组织(WHO)推荐的A1级广谱、安全、高效消毒剂。以下是ClO2的两种制备方法:
方法一:2NaClO3 + 4HCl → 2ClO2↑+ Cl2↑+ 2NaCl + 2H2O
方法二:H2C2O4 + 2NaClO3 + H2SO4 → Na2SO4 + 2CO2↑ + 2ClO2↑ + 2H2O
完成下列填空:
(1)在方法一中,当有0.2 mol电子发生转移时,参与反应的还原剂为_________ mol。
(2)在方法二中,反应物H2C2O4_________(填序号)。
a.仅做氧化剂 b.既被氧化又被还原
c.发生氧化反应 d.既未被氧化也未被还原
(3)两种方法相比,___________(填写“方法一”或“方法二”)制备的ClO2更适合用于饮用水的消毒,其主要原因是______________________________________________。
(4)实验室也可用氯酸钠(NaClO3)和亚硫酸钠(Na2SO3)用硫酸酸化,加热制备二氧化氯,其化学反应方程式为 ________________________________________________。
(5)氯原子核外共有______种不同运动状态的电子,氯离子的最外层电子排布式是________。
(6)CCl4分子的空间构型为__________________,CO2的电子式是___________________。
(7)相同压强下,部分元素氯化物的熔点见表:
氯化物 | NaCl | KCl | CCl4 |
熔点/℃ | 804 | 773 | -22.92 |
试解释表中氯化物熔点差异的原因:_______________________________________________________。