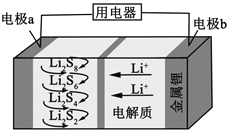
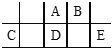
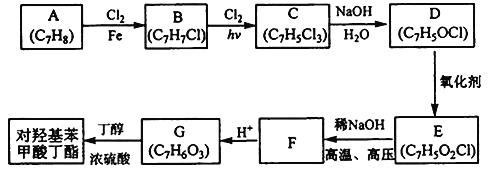
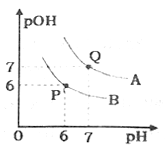
题目内容
【题目】将硫酸铝、硫酸铁和明矾溶液[KAl(SO4)2]等体积等浓度混合。该混合溶液中SO42-浓度为0.4mol/L。取100mL混合液加入0.4mol/L的KOH溶液,若要产生的沉淀量最大,加入该浓度的KOH的体积是( )
A. 100mL B. 150mL C. 200mL D. 250mL
【答案】B
【解析】将硫酸铝、硫酸铁和明矾溶液[KAl(SO4)2]等体积等浓度混合,浓度设为x。该混合溶液中SO42-浓度为0.4mol/L。则(3x+x+2x)/3=0.4mol/L,解得x=0.2mol/L.取100ml混合液加入0.4mol/L的KOH溶液,若要产生的沉淀量最大时,溶质为硫酸钾,则最终混合液中钾离子的物质的量为![]() ,由于三种溶液为等体积混合,则取出的100mL混合液中含有原三种溶液体积均为0.1L/3,100mL混合液中含有钾离子的物质的量为
,由于三种溶液为等体积混合,则取出的100mL混合液中含有原三种溶液体积均为0.1L/3,100mL混合液中含有钾离子的物质的量为![]() ,根据钾离子守恒,需要加入的KOH的物质的量为:0.08mol-0.02mol=0.06mol,所以需要加入的0.4mol/L的KOH溶液体积为
,根据钾离子守恒,需要加入的KOH的物质的量为:0.08mol-0.02mol=0.06mol,所以需要加入的0.4mol/L的KOH溶液体积为![]() ,故选B。
,故选B。

【题目】以硅藻土为载体的五氧化二钒(V2O5)是接触法生产硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
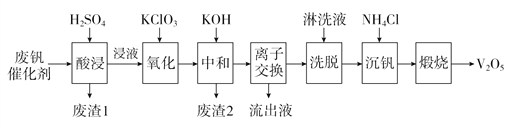
回答下列问题:
(1)“酸浸”时V2O5转化为VO![]() ,反应的离子方程式为______________,同时V2O4转化成VO2+。“废渣1”的主要成分是________。
,反应的离子方程式为______________,同时V2O4转化成VO2+。“废渣1”的主要成分是________。
(2)“氧化”中欲使3 mol的VO2+变为VO![]() ,则需要氧化剂KClO3至少为________mol。
,则需要氧化剂KClO3至少为________mol。