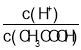题目内容
【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
![]()
(1)写出A、B、C三元素的元素符号_____、_____、_____。
(2)C在元素周期表中的位置是_____。
(3)B的原子结构示意图为_____,C的氢化物与B的氢化物的稳定性强弱顺序为_____(填化学式)。
(4)比较A、C的原子半径:A_____C,写出A的气态氢化物与A的最高价氧化物对应水化物反应的化学方程式:_____。
【答案】N S F 第二周期ⅦA族 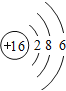 HF>H2S > NH3+ HNO3= NH4NO3
HF>H2S > NH3+ HNO3= NH4NO3
【解析】
A、B、C为短周期元素,由它们在周期表中的位置,可知A、C处于第二周期,B处于第三周期,令A原子核外电子为x,则B质子数为x+9,C核外电子数为x+2,则:x+x+2=x+9,解得x=7,故A为N元素、B为S元素、C为F元素,据此分析。
(1)由上述分析可知,A为N元素、B为S元素、C为F元素,故答案为:N;S;F;
(2)C为F元素,核外电子数为9,有2个电子层,最外层电子数为7,处于第二周期ⅦA族;
(3)B为S元素,原子结构示意图为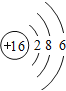 ;C为F元素,非金属性F>S,非金属性越强,气态氢化物的稳定性越强,则氢化物的稳定性强弱顺序为HF>H2S;
;C为F元素,非金属性F>S,非金属性越强,气态氢化物的稳定性越强,则氢化物的稳定性强弱顺序为HF>H2S;
(4)A为N元素、C为F元素,同周期元素从左到右原子半径依次减小,则原子半径N>F;A的气态氢化物为NH3,A的最高价氧化物对应水化物为HNO3,二者反应生成NH4NO3,反应的化学方程式为:NH3+ HNO3= NH4NO3。

练习册系列答案
相关题目