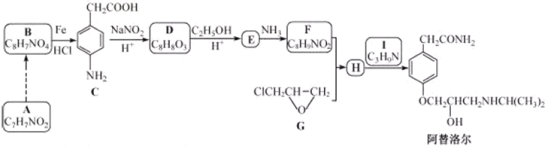
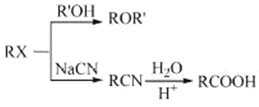
题目内容
【题目】设[aX+bY]为a个X微粒和b个Y微粒组成的一个微粒集合体,NA为阿伏加德罗常数的值。下列说法不正确的是
A.H2(g)+![]() O2(g)=H2O(l) ΔH=-286 kJ·mol1,则每1 mol [H2(g)+
O2(g)=H2O(l) ΔH=-286 kJ·mol1,则每1 mol [H2(g)+![]() O2(g)]生成1 mol [H2O(l)]放热286 kJ
O2(g)]生成1 mol [H2O(l)]放热286 kJ
B.Cr2O72-+ne+14H+=2Cr3++7H2O,则每生成1 mol Cr3+转移电子数为3NA
C.Al3++4OH=[Al(OH)4],说明1 mol Al(OH)3电离出H+数为NA
D.1 mol CO2与NaOH溶液完全反应,则n(CO32-)+n(HCO3-)+n(H2CO3)=1 mol
【答案】C
【解析】
A项、由热化学方程式可知,氢气在氧气中的燃烧为放热反应,1 mol [H2(g)+![]() O2(g)]生成1 mol [H2O(l)]放热286 kJ,故A正确;
O2(g)]生成1 mol [H2O(l)]放热286 kJ,故A正确;
B项、由铬元素化合价变化可知,生成2 mol Cr3+转移6mol电子,则生成1 mol Cr3+转移电子数为3NA,故B正确;
C项、氢氧化铝是两性氢氧化物,在溶液中发生酸式电离部分电离出氢离子,则1 mol Al(OH)3电离出H+数小于NA,故C错误;
D项、由碳原子个数守恒可知,1 mol CO2与NaOH溶液完全反应生成的盐溶液中,n(CO32-)+n(HCO3-)+n(H2CO3)=1 mol,故D正确;
故选C。

【题目】下表是氧化镁和氯化镁的熔、沸点数据:
物质 | 氧化镁 | 氯化镁 |
熔点/℃ | 2852 | 714 |
沸点/℃ | 3600 | 1412 |
请参考以上数据分析,从海水中提取镁,正确的方法是( )
A.海水![]() Mg(OH)2
Mg(OH)2![]() Mg
Mg
B.海水![]() MgCl2溶液→MgCl2晶体
MgCl2溶液→MgCl2晶体![]() Mg
Mg
C.海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
D.海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液
MgCl2溶液![]() MgCl2(熔融)
MgCl2(熔融)![]() Mg
Mg