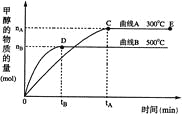
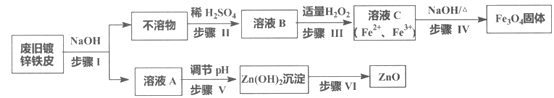
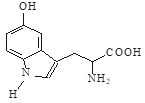
题目内容
【题目】已知反应 CO(g)+H2O(g)CO2(g)+H2(g) △H = -43kJ·mol-1,在850℃时K=1。今在某密闭容器中充入1.0molCO、3.0molH2O、1.0molCO2和x molH2,下列说法不正确的是
A.900℃ 时,该反应的平衡常数 K<1
B.850℃ 时,若x=5.0,则起始时反应向逆反应方向进行
C.850℃达到化学平衡后,通入CO,化学平衡逆向移动
D.850℃时,若要使上述反应开始时向正反应方向进行,则x 应满足x<3.0
【答案】C
【解析】
A.由于该反应为放热反应,900℃时,温度升高,平衡逆向移动,反应的平衡常数减小,即K<1,A正确;
B.该反应前后气体系数之和相等,可用物质的量代替物质的量浓度计算浓度熵,850℃ 时,若x=5.0,浓度熵![]() >1,平衡逆向移动,B正确;
>1,平衡逆向移动,B正确;
C.850℃达到化学平衡后,通入CO,反应物浓度增大,化学平衡正向移动,C错误;
D.850℃时,若要使上述反应开始时向正反应方向进行,达平衡时的数值为最大极限值,平衡时![]() ,x=3,因此x应满足x<3.0,D正确;
,x=3,因此x应满足x<3.0,D正确;
答案选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目