题目内容
15.某学生为了探究锌与盐酸反应生成氢气过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(2)哪一段时段的反应速率最小4~5min,原因是盐酸浓度减小(氢离子浓度减小)(.
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,可在盐酸中分别加入等体积的下列溶液,你认为可行的是B.
A.Na2CO3溶液 B.NaCl溶液 C.NaNO3溶液 D.CuSO4溶液
(4)如果要使产生氢气的速率加快你认为可行的措施有哪些?(至少写两条)升温、增大盐酸浓度(或加入少量的硫酸铜溶液;减小锌粉的颗粒度).
分析 (1)先计算每个时间段的气体体积,然后根据相同条件下,气体体积与反应速率的关系判断反应速率大小,根据该反应与能量变化的关系判断速率变化原因;
(2)先计算每个时间段的气体体积,然后根据相同条件下,气体体积与反应速率的关系判断反应速率大小,根据浓度与化学反应速率的关系判断速率变化的原因;
(3)根据浓度、电解质的强弱对反应速率的影响判断;
(4)增大反应速率,可增大浓度、升高温度或形成原电池反应等.
解答 解:(1)相同通条件下,反应速率越大,相同时间内收集的气体越多;由表中数据可知,反应速率最大的时间段是2~3 min,原因是:该反应是放热反应,温度越高,反应速率越大.
故答案为:2~3min;反应放热,加快反应速率;
(2)相同通条件下,反应速率越小,相同时间内收集的气体越少;过计算得,反应速率最小的时间段是:4~5min;原因是:随着反应的进行,盐酸的浓度在减小,浓度越小,反应速率越慢.
故答案为:4~5min;盐酸浓度减小(氢离子浓度减小);
(3)改变化学反应速率的方法有:改变溶液的浓度、改变溶液的温度、改变固体的表面积等,
A.加Na2CO3溶液,溶液的体积增大,盐酸的浓度降低,但盐酸和碳酸钠反应生成二氧化碳,氢气的量减小,故A错误;
B.加NaCl溶液,溶液的体积增大,浓度降低,反应速率减小,但生成的气体的量不变,故B正确;
C.加入硝酸钠,硝酸根离子在酸性条件下具有强氧化性,反应生成NO气体,影响了氢气的量,故C错误;
D.加CuSO4溶液,能形成铜锌原电池,加快反应速率,故D错误;
故答案为:B;
(4)增大反应速率,可通过升温、增大盐酸浓度、加入少量的硫酸铜溶液、减小锌粉的颗粒度等方法实现,
故答案为:升温、增大盐酸浓度(或加入少量的硫酸铜溶液;减小锌粉的颗粒度).
点评 本题考查反应速率的影响因素,为高频考点,题目难度中等,侧重于学生的分析能力和实验能力的考查,注意把握浓度、温度、催化剂、固体表面积等因素对反应速率的影响.

 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案 的说法,不正确的是( )
的说法,不正确的是( )| A. | 既可催化加氢,又能使酸性KMnO4溶液褪色 | |
| B. | 可与浓溴水发取代生反应,但不能发生消去反应 | |
| C. | 1mol该化合物最多可与10molNaOH反应 | |
| D. | 可与FeCl3溶液发生显色反应,不与NaHCO3反应放出CO2 |
| A. | 石墨转化为金刚石 | B. | NaCl晶体溶于水 | ||
| C. | 干冰升华 | D. | HCl溶于水 |
| A. | 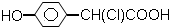 | B. | CH3CH (OH)-CH=CH-COOH | ||
| C. | CH3-CH=CH-COOH | D. | CH3CH(OH)CH2CHO |
| A. | 用湿润的红色石蕊试纸检验氨气 | |
| B. | 过量的铜与浓硝酸反应有一氧化氮生成 | |
| C. | 金属钠着火时,可用二氧化碳灭火器灭火 | |
| D. | Na2CO3的热稳定性大于NaHCO3 |
| A. | Al→Al2O3→Al(OH)3→NaAlO2 | B. | Si→SiO2→H2SiO3→Na2SiO3 | ||
| C. | N2→NO→NO2→HNO3 | D. | S→SO3→H2SO4→MgSO4 |

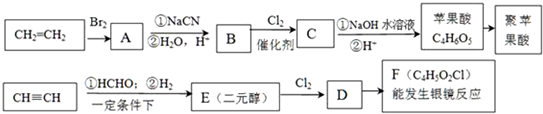
 .
.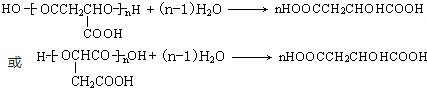 .
.