题目内容
6.有甲、乙两溶液,各含有下列14种离子中的7种:Al3+、Cl-、Na+、K+、NO3-、OH-、S2-、MnO4-、Fe3+、AlO2-、CO32-、NH4+、SO42-、H+.已知两溶液所含离子各不相同,甲溶液里只有2种阳离子,则甲溶液中的阳离子是Na+、K+,乙溶液中的阴离子是NO3-、MnO4-、SO42-或MnO4-、SO42-、Cl-.分析 两溶液所含离子各不相同,甲溶液里的阳离子只有两种,由H+、NH4+、Fe3+、A13+均能与OH-反应,则甲中的阳离子只能为K+、Na+;则乙中的阳离子为H+、NH4+、Fe3+、A13+,与乙中阳离子反应的阴离子应在甲中,剩余的阴离子在乙中,以此进行解答.
解答 解:由溶液中离子之间的反应可知,Al3+、Fe3+、NH4+、H+与OH-不能大量共存,且甲溶液里的阳离子只有两种,所以Al3+、Fe3+、NH4+、H+在乙溶液中,OH-在甲溶液中,由此知甲溶液呈碱性,乙溶液呈酸性,
乙溶液呈酸性,能和酸反应的离子AlO2-、CO32-、S2-不能在乙溶液中,只能在甲溶液中,高锰酸根离子有强氧化性,不能和氯离子、硫离子共存,所以氯离子和硫离子存在于甲溶液中,甲溶液里的阳离子只有两种,Na+、K+在甲溶液中,甲、乙两溶液各含14种离子中的7种,所以NO3-(或Cl-)、SO42-在乙溶液中,
由以上分析知,甲溶液中存在的离子为:Cl-(或NO3-)、Na+、K+、OH-、S2-、AlO2-、CO32-,
乙溶液中存在的离子为:Al3+、NO3-(或Cl-)、MnO4-、Fe3+、NH4+、SO42-、H+,
所以甲溶液中的阳离子为:Na+、K+;乙溶液中的阴离子为:NO3-、MnO4-、SO42-或MnO4-、SO42-、Cl-,
故答案为:Na+、K+;NO3-、MnO4-、SO42-或MnO4-、SO42-、Cl-.
点评 本题考查离子的共存问题,题目难度中等,注意能与氢氧根离子反应的阳离子有四种是解答本题的突破口,熟悉离子的性质及检验方法为解答关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.下列说法正确的是( )
| A. | CO2、CH4都属于极性键的非极性分子 | |
| B. | C、N、O、F 电负性依次减小 | |
| C. | 基态铜(Cu)原子的电子排布式为[Ar]3d94s2 | |
| D. | 价电子构型为3s23p4的粒子其电子排布图为: |
18.下列物质中既能与盐酸反应,又能与NaOH溶液反应的是( )
①NaHCO3 ②(NH4)2S ③Al(OH)3 ④NH4Cl ⑤H2N-CH2-COOH ⑥CH3COOH.
①NaHCO3 ②(NH4)2S ③Al(OH)3 ④NH4Cl ⑤H2N-CH2-COOH ⑥CH3COOH.
| A. | ①②③ | B. | ①②④⑤ | C. | ⑤⑥ | D. | ①②③⑤ |
15.某学生为了探究锌与盐酸反应生成氢气过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
(1)哪一时间段反应速率最大2~3min,原因是反应放热,加快反应速率.(指0~1、1~2、2~3、3~4、4~5min)
(2)哪一段时段的反应速率最小4~5min,原因是盐酸浓度减小(氢离子浓度减小)(.
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,可在盐酸中分别加入等体积的下列溶液,你认为可行的是B.
A.Na2CO3溶液 B.NaCl溶液 C.NaNO3溶液 D.CuSO4溶液
(4)如果要使产生氢气的速率加快你认为可行的措施有哪些?(至少写两条)升温、增大盐酸浓度(或加入少量的硫酸铜溶液;减小锌粉的颗粒度).
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(2)哪一段时段的反应速率最小4~5min,原因是盐酸浓度减小(氢离子浓度减小)(.
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,可在盐酸中分别加入等体积的下列溶液,你认为可行的是B.
A.Na2CO3溶液 B.NaCl溶液 C.NaNO3溶液 D.CuSO4溶液
(4)如果要使产生氢气的速率加快你认为可行的措施有哪些?(至少写两条)升温、增大盐酸浓度(或加入少量的硫酸铜溶液;减小锌粉的颗粒度).

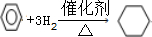
 ,BN中B元素的化合价为+3;
,BN中B元素的化合价为+3; ,其二氯代物有4种.
,其二氯代物有4种.
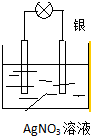 利用化学反应将存储在物质内部的化学能转化为电能,科学家设计出了原电池,从而为人类生产、生活提供能量.
利用化学反应将存储在物质内部的化学能转化为电能,科学家设计出了原电池,从而为人类生产、生活提供能量.