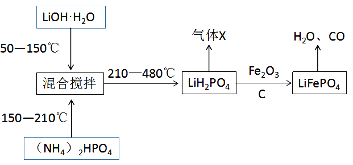
题目内容
【题目】硝酸铵是一种重要的化工原料,通常用合成氨及合成硝酸的产物进行生产
(1)硝酸铵水溶液pH__________7(填“>”、“=”或“<”),其水溶液中各种离子浓度大小关系为___________
(2)已知合成氨的热化学方程式为:N2(g)+ 3H2(g)![]() 2NH3(g)△H=-92kJ/mol,按照氮气和氢气的物质的量之比1:3的比例,分别在200℃、400℃、600℃的条件下进行反应,生成物NH3的物质的量分数随压强的变化曲线如图所示
2NH3(g)△H=-92kJ/mol,按照氮气和氢气的物质的量之比1:3的比例,分别在200℃、400℃、600℃的条件下进行反应,生成物NH3的物质的量分数随压强的变化曲线如图所示
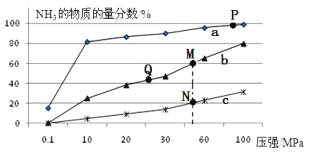
①曲线c对应的温度为___________ ℃
②下列说法中正确的是___________
A.增大氢气浓度,可促进平衡正向移动并能提高氮气的转化率
B.Q点对应的反应条件下,若加入适当的催化剂,可提高NH3在混合物中的物质的量分数
C.M、N两点的平衡常数大小关系为:M>N
D.M、N、Q三点反应速率的大小关系为:N>M>Q
E.为了尽可能多的得到NH3,应当选择P点对应的温度和压强作为生产条件
(3)尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)=H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式:_________________________
(4)柴油汽车尾气净化器通常用尿素作为氮氧化物尾气的吸收剂,生成物均为无毒无污染的常见物质,请写出尿素与NO反应的化学方程式__________,当有1mol尿素完全反应时,转移电子的数目为___________
【答案】< NO3->NH4+>H+>OH- 600 ACD 2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) ΔH=-134kJ·mol-1 2CO(NH2)2 + 6NO = 2CO2 + 5N2 + 4H2O 6NA
【解析】
(1)硝酸铵溶于水NH4+易水解,NH4++H2O![]() NH3.H2O +H+,因此溶液呈弱酸性,即pH<7,水溶液中各种离子浓度大小关系为NO3->NH4+>H+>OH-;
NH3.H2O +H+,因此溶液呈弱酸性,即pH<7,水溶液中各种离子浓度大小关系为NO3->NH4+>H+>OH-;
(2)①相同压强下,升高温度平衡逆向移动,氨气含量降低,根据图知,a、b、c的温度分别是200℃、400℃、600℃,因此,本题正确答案是:600℃;
②A.增大氢气浓度,即增加反应物浓度,可促进平衡正向移动并能提高氮气的转化率,故A正确;
B.催化剂只能相同程度的改变正逆反应速率,不能使化学平衡移动,故B错误;
C.M、N两点压强相同,M和N的温度不同,M点氨气质量分数大于N,说明平衡常数M>N,故C正确;
D.两点压强相同,M点的温度低于N的温度,所以反应速率N>M,M和Q的温度相同,压强M大于Q,所以反应速率M>Q,故D正确;
综上所述,本题应选ACD;
(3)已知反应①2NH3(g)+CO2(g)=H2NCOONH4(s) ΔH1=-272kJ·mol-1,反应②H2NCOONH4(s)=CO(NH2)2(s)+H2O(g) ΔH2=+138kJ·mol-1
根据盖斯定律,由①+②式得2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) ΔH= ΔH1+ΔH2=-134kJ·mol-1
(4)根据尿素作为氮氧化物尾气的吸收剂,生成物均为无毒无污染的常见物质,可知生成物应为氮气、二氧化碳和水,CO(NH2)2 中N化合价由-3价升为0价,NO中N的化合价由+2价降为0价,根据得失电子守恒可知CO(NH2)2 与NO反应中的系数之比为1:3,根据质量守恒可配平方程式:2CO(NH2)2 + 6NO = 2CO2 + 5N2 + 4H2O,1mol尿素完全反应时,转移电子6mol,即数目为6NA个。

【题目】根据我国目前汽车业发展速度,预计![]() 年汽车保有量超过
年汽车保有量超过![]() 亿辆,中国已成为全球最大的汽车市场。因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题。
亿辆,中国已成为全球最大的汽车市场。因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题。
(1)目前,汽车厂商常利用催化技术将尾气中的![]() 和
和![]() 转化成
转化成![]() 和
和![]() ,化学方程式为:_______________;
,化学方程式为:_______________;
为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究:
(资料查阅)①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响.
(实验设计)课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
(2)完成以下实验设计表(表中不要留空格)。
实验编号 | 实验目的 | T / ℃ |
|
| 同种催化剂的比表面积
|
| 为以下实验作参照 |
|
|
|
|
| ①___________ | 280 |
|
|
|
| 探究温度对尾气转化速率的影响 |
| ②_________ |
|
|
(图象分析与结论)利用气体传感器测定了三组实验中![]() 浓度随时间变化的曲线图,如图:
浓度随时间变化的曲线图,如图:
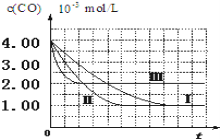
(3)计算第![]() 组实验中,达平衡时
组实验中,达平衡时![]() 的浓度为________;
的浓度为________;
(4)由曲线![]() 、
、![]() 可知,增大催化剂比表面积,汽车尾气转化速率____________________(填“增大”、“减小”、“无影响”)。
可知,增大催化剂比表面积,汽车尾气转化速率____________________(填“增大”、“减小”、“无影响”)。
(5)下列措施中,能减少或控制汽车尾气污染有效且可行的是________.
A.制定严格的汽车尾气排放标准,并严格执行
B.开发清洁能源汽车,如氢能汽车、太阳能汽车等
C.将污染源移到人口密集度低的郊区