题目内容
【题目】已知葡萄糖在乳酸菌作用下可转化为乳酸(C3H6O3)。
(1)取9 g乳酸与足量的金属Na反应,可生成2.24 L H2(标准状况),另取等量乳酸与等物质的量的乙醇反应,生成0.1 mol乳酸乙酯和1.8 g水,由此可推断乳酸分子中含有的官能团名称为____________。
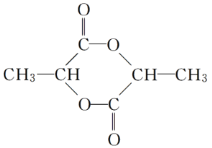
(2)乳酸在Cu作催化剂时可被氧化成丙酮酸(![]() ),由以上事实推知乳酸的结构简式为________________。
),由以上事实推知乳酸的结构简式为________________。
(3)两个乳酸分子在一定条件下脱水生成环脂(C6H8O4),则此环酯的结构简式是____。
(4)乳酸在浓H2SO4作用下,三分子相互反应,生成链状结构的物质,写出其生成物的结构简式:___________________________________________________________。
【答案】羧基、醇羟基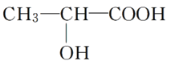

【解析】
(1)9.0g乳酸的物质的量=9g÷90g/mol=0.1mol,氢气的物质的量=2.24L÷22.4L/mol=0.1mol,0.1mol乳酸与足量金属钠反应,可产生0.1mol气体(标准状况),0.1mol乳酸与足量金属钠反应,可产生0.1mol气体(标准状况),说明乳酸中有两个官能团和钠反应,0.1mol乳酸与相同物质的量的乙醇反应,生成0.1mol乳酸乙酯和1.8gH2O,说明一个乳酸分子中含有一个羧基,则乳酸分子中另一个官能团是醇羟基,故答案为:羧基、醇羟基;(2)乳酸在铜作催化剂时,可氧化成丙酮酸(CH3COCOOH),说明醇羟基位于中间碳原子上,故其结构简式为:![]() ;(3)由酯化反应的机理可知两个乳酸分子形成环酯的结构简式为:
;(3)由酯化反应的机理可知两个乳酸分子形成环酯的结构简式为: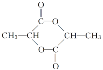 ;(4)三分子乳酸相互反应,生成链状结构的反应原理依然是酯化反应,则生成物质的结构简式为:
;(4)三分子乳酸相互反应,生成链状结构的反应原理依然是酯化反应,则生成物质的结构简式为: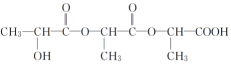

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目