题目内容
【题目】化学电池一直是化学工作者研究的热点之一。
Ⅰ.早期的锌汞纽扣式电池,以锌和氧化汞为电极材料,氢氧化钾溶液为电解液的原电池,有效的解决电池使用寿命短、易发生漏液等问题。
电池总反应为:Zn+HgO = ZnO+Hg。
(1)该电池的正极反应式是___________。
(2)但是该工厂的污水中会含有一定量的+2价的汞离子,通常采用向污水中通入一定量的硫化氢,反应的离子方程式为___________。
(3)该方法的缺点是产物的颗粒比较小,大部分悬浮于污水中,通常采用投入一定量的明矾晶体进行后续处理,请解释其原因___________。
II.锂离子电池由于轻便、比能量大等优点,成为当今社会最为常见的电池。其中的重要材料磷酸亚铁锂(LiFePO4)通常按照下列流程进行生产:
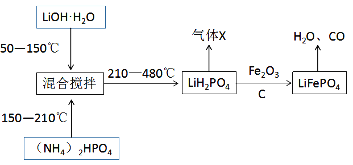
请回答下列问题:
(4)生产过程中“混合搅拌”的目的是__________。气体X除了水蒸气之外,还含有___________(填写化学式)。
(5)请写出一定条件下由LiH2PO4生成LiFePO4的化学方程式__________,当生成1mol磷酸亚铁锂时,转移的电子数目为___________。
【答案】HgO + 2e- + H2O = Hg + 2OH- Hg2+ + H2S = HgS + 2H+ 水解产生的Al(OH)3胶体具有吸附性 加快反应速率 NH3 2LiH2PO4 + Fe2O3 + C =2LiFePO4 + CO ↑+ 2H2O 1NA
【解析】
(1)原电池正极得到电子发生还原反应,HgO得电子生成Hg,电解液为氢氧化钾溶液,则该电极反应式为:HgO + 2e- + H2O = Hg + 2OH-;
(2)硫离子与汞离子反应生成硫化汞沉淀,反应的离子方程式为:Hg2+ + H2S = HgS + 2H+;
(3)明矾溶于水电离出Al3+,Al3+水解生成的氢氧化铝胶体具有吸附性,可吸附HgS微粒,加快微粒的沉降;
(4)生产过程中“混合搅拌”的目的是使反应物充分混合接触,提高反应速率;高温可促进NH4+的水解,并放出NH3,故气体X为NH3;
(5)如流程图所示,LiH2PO4与Fe2O3、C反应生成LiFePO4,Fe3+被还原为Fe2+,C被氧化生成CO(其中C元素化合价为+2价),根据氧化还原反应中得失电子守恒可知,Fe2O3与C的化学计量数之比为1:1,再根据反应前后原子个数守恒配平化学方程式可得:2LiH2PO4 + Fe2O3 + C =2LiFePO4 + CO ↑+ 2H2O;当生成1mol磷酸亚铁锂时,转移电子数目为1mol,即1NA。

 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案【题目】下表实验、现象和结论均正确的是
选项 | 实验 | 现象 | 结论 |
A | 向浓度均为0.lmol·L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
B | 向某溶液中滴加足量稀硫酸 | 溶液中出现了气泡和淡黄色浑浊 | 溶液中可能含有S2O32- |
C | 常温下,用pH试纸测定等物质的量浓度的NaCN和NaClO溶液pH | 前者的 pH比后者的大 | 水解程度:CN-<ClO- |
D | 向FeCl3和KSCN混合溶液中,加入少量KCl的固体(已知FeCl3 +KSCN | 溶液颜色变浅 | 平衡向逆反应方向移动 |
A. A B. B C. C D. D