题目内容
【题目】按要求回答下列问题。
(1)下列基态原子或离子的电子排布式或轨道表示式正确的是_______(填序号,下同),违反能量最低原理的是_____,违反泡利不相容原理的是_____,违反洪特规则的是_______。
①Si:![]()
②Al:![]()
③Co3+最外层:![]()
④Mg2+:1s22s22p6
⑤Sc:1s22s22p63s23p63d3
⑥Cr:1s22s22p63s23p63d54s1
(2)物质:①甲烷 ②硫化氢 ③氢氧化镁 ④氨气 ⑤乙烯
条件 | 符合条件物质的序号 |
既含极性键又含非极性键 | ______ |
含有极性键的极性分子 | ______ |
上述分子中键角由大到小的顺序 | ______ |
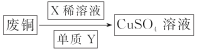
(3)甲图FeO晶胞中与Fe2+最近的Fe2+的个数为__________;乙图晶胞中A、B两种微粒个数比为______;丙图晶胞中A、B两种微粒个数比为_________。
甲. 乙.
乙.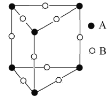 丙.
丙.
【答案】④⑥ ⑤ ② ①③ ⑤ ②④ ⑤①④② 12 1:4 1:3
【解析】
核外电子排布需满足3个原理或规则,即:
能量最低原理:原子核外电子先占有能量较低的轨道,然后依次进入能量较高的轨道;
泡利不相容原理:每个原子轨道上最多只能容纳2个自旋状态相反的电子;
洪特规则:在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同,据此回答。
(1) ①Si的3p轨道的两个电子应为![]()
![]()
![]() ,图上违反了洪特规则,①错误;
,图上违反了洪特规则,①错误;
②Al的2p轨道成对的电子应当自旋相反,图上违反了泡利不相容原理,②错误;
③Co为27号元素,Co3+有24个电子,价电子排布图应为![]() ,图上违反了洪特规则,③错误;
,图上违反了洪特规则,③错误;
④Mg2+有12-2=10个电子,其核外电子排布式为:1s22s22p6,④正确;
⑤Sc为21号元素,基态Sc原子核外电子排布式为:1s22s22p63s23p63d14s2,题上违反了能量最低原理,⑤错误;
⑥Cr为24号元素,基态Cr原子核外电子排布式为:1s22s22p63s23p63d54s1,⑥正确;
综上所述,④⑥正确。
故答案为:④⑥;⑤;②;①③;
(2)活泼金属与非金属原子之间易形成离子键,非金属原子之间易形成共价键,同种原子之间形成的共价键称为非极性键,不同种原子之间形成共价键称为极性键。
①甲烷:C和H之间以极性键结合成正四面体,键角109°28’,正负电荷重心重合,为非极性分子;
②硫化氢中S和H之间以极性键结合,硫化氢是V形分子,键角92°,正负电荷重心不重合,为极性分子;
③氢氧化镁中Mg2+和OH-之间以离子键结合,是离子化合物,H和O之间以极性键结合;
④氨气中N和H之间以极性键结合,为三角锥形分子,键角107°18’,正负电荷重心不重合,为极性分子;
⑤乙烯(CH2=CH2)中,C和C以非极性键结合成碳碳双键,C和H之间以极性键结合,乙烯是平面型分子,键角120°,正负电荷重心重合,为非极性分子;
故答案为:⑤;②④;⑤①④②;
(3)甲:以上面面心的Fe2+为例,该Fe2+到水平面的四个Fe2+,下方的4个侧面面心的Fe2+,还有上方的4个侧面面心的Fe2+的距离都相当,为最小距离;
乙图:根据均摊法,A粒子个数=6![]() =0.5,B粒子个数=
=0.5,B粒子个数=![]() =2,A、B粒子个数比=0.5:2=1:4;
=2,A、B粒子个数比=0.5:2=1:4;
丙图:A粒子个数=![]() =1,B粒子个数=12
=1,B粒子个数=12![]() =3,A、B粒子个数比=1:3。
=3,A、B粒子个数比=1:3。
故答案为:12;1:4;1:3。

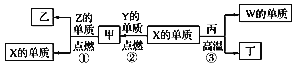
【题目】氢气是一种清洁能源。在冶金、电力、材料等领域应用广泛。请回答下列问题:
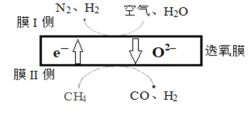
(1)某科研团队利用透氧膜获得N2、H2的工作原理如图所示(空气中N2和O2的物质的量之比为4:1)。上述过程中,膜I侧所得气体的物质的量之比为n(H2):n(N2)=3:1,则氧化作用的物质为_______________,膜Ⅱ侧发生的电极反应式为_________________
(2)用CO和H2合成甲醇的热化学方程式为CO(g)+2H2(g) CH3OH(g) △H1
已知CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2=-49.0kJ/mol
CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.1kJ/mol
则△H1=________________
(3)向体积可变的密闭容器中充入1molCO和2.2molH2,在恒温恒压条件下发生反应:CO(g)+2H2(g) CH3OH(g),平衡时,CO的转化率α(CO)随温度、压强的变化情况如图1所示。
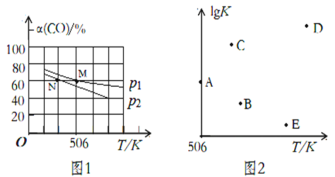
①压强p1_____(填“>”、“<”或“=”)p2;M点时,该反应的平衡常数Kp=______(用平衡分压表示,分压=总压×物质的量分数)
②不同温度下,该反应的平衡常数的对数值lgK如图2,其中A点为506K时平衡常数的对数值,则B、C、D、E四点中能正确表示该反应的lgK与温度(T)的关系的是_____________
(4)H2还原NO的反应为2NO(g)+2H2(g)N2(g)+2H2O(l),实验测得反应速率的表达式为v=k·cm(NO)·cn(H2)(k是速率常数,只与温度有关)。
①某温度下,反应速率与反应物浓度的变化关系如下表所示。
编号 | c(H2)/(mol·L-1) | c(NO)/(mol·L-1) | v/(mol·L-1·min-1) |
1 | 0.10 | 0.10 | 0.414 |
2 | 0.10 | 0.20 | 1.656 |
3 | 0.50 | 0.10 | 2.070 |
由表中数据可知,m=_______,n=_______。
②上述反应分两步进行:ⅰ2NO(g)+2H2(g) N2(g)+H2O2(l)(慢反应)
ⅱH2O2(l)+H2(g) 2H2O(l)(快反应)。下列说法正确的是_______
A. H2O2是该反应的催化剂 B. 总反应速率由反应ⅱ的速率决定
C. 反应ⅰ的活化能较高 D.反应ⅰ中NO和H2的碰撞仅部分有效
【题目】有机物A为天然蛋白质水解产物,含有C、H、N、O四种元素。某研究小组为研究A的组成与结构,进行了如下实验:
实验步骤 | 实验结论 |
(1)将A加热使其气化,测其密度约为相同条件下空气密度的4.6倍。 | A的相对分子质量为_____ |
(2)将26.6gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰、灼热的铜网(假设每次气体被完全吸收),前两者分别增重12.6g和35.2g,通过铜网后收集到的气体为2.24L(标准状况下)。 | A的分子式为_______ |
(3)另取13.3gA,与足量的NaHCO3粉末完全反应,生成气体4.48L(标准状况下)。 | A中含有的官能团名称为____ |
(4)A的核磁共振氢谱显示五组峰且峰面积比为1:1:1:2:2。 | A的结构简式为_______ |
(5)两分子A反应生成一种六元环状化合物的化学方程式为_________ | |