题目内容
【题目】氢气是一种清洁能源。在冶金、电力、材料等领域应用广泛。请回答下列问题:
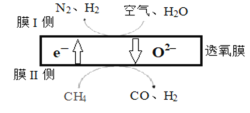
(1)某科研团队利用透氧膜获得N2、H2的工作原理如图所示(空气中N2和O2的物质的量之比为4:1)。上述过程中,膜I侧所得气体的物质的量之比为n(H2):n(N2)=3:1,则氧化作用的物质为_______________,膜Ⅱ侧发生的电极反应式为_________________
(2)用CO和H2合成甲醇的热化学方程式为CO(g)+2H2(g) CH3OH(g) △H1
已知CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2=-49.0kJ/mol
CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.1kJ/mol
则△H1=________________
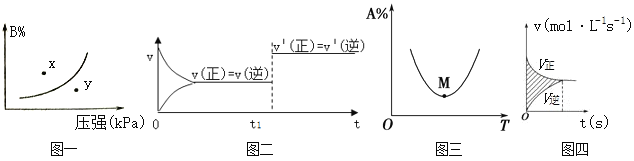
(3)向体积可变的密闭容器中充入1molCO和2.2molH2,在恒温恒压条件下发生反应:CO(g)+2H2(g) CH3OH(g),平衡时,CO的转化率α(CO)随温度、压强的变化情况如图1所示。
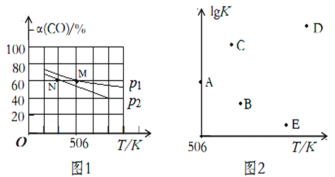
①压强p1_____(填“>”、“<”或“=”)p2;M点时,该反应的平衡常数Kp=______(用平衡分压表示,分压=总压×物质的量分数)
②不同温度下,该反应的平衡常数的对数值lgK如图2,其中A点为506K时平衡常数的对数值,则B、C、D、E四点中能正确表示该反应的lgK与温度(T)的关系的是_____________
(4)H2还原NO的反应为2NO(g)+2H2(g)N2(g)+2H2O(l),实验测得反应速率的表达式为v=k·cm(NO)·cn(H2)(k是速率常数,只与温度有关)。
①某温度下,反应速率与反应物浓度的变化关系如下表所示。
编号 | c(H2)/(mol·L-1) | c(NO)/(mol·L-1) | v/(mol·L-1·min-1) |
1 | 0.10 | 0.10 | 0.414 |
2 | 0.10 | 0.20 | 1.656 |
3 | 0.50 | 0.10 | 2.070 |
由表中数据可知,m=_______,n=_______。
②上述反应分两步进行:ⅰ2NO(g)+2H2(g) N2(g)+H2O2(l)(慢反应)
ⅱH2O2(l)+H2(g) 2H2O(l)(快反应)。下列说法正确的是_______
A. H2O2是该反应的催化剂 B. 总反应速率由反应ⅱ的速率决定
C. 反应ⅰ的活化能较高 D.反应ⅰ中NO和H2的碰撞仅部分有效
【答案】CH4 CH4+ O2—-2e—=CO+2H2 —90.1 kJ/mol > ![]() B、E 2 1 C D
B、E 2 1 C D
【解析】
(1)空气中N2和O2的物质的量之比为4:1,膜I侧所得气体的物质的量之比为n(H2):n(N2)=3:1,氮气的量在反应前后不变,则设氮气的物质的量为4mol,则生成氢气的物质的量为12mol,由膜I侧反应可知,12mol水得到电子,1mol氧气得到电子,做氧化剂,根据图示,膜Ⅱ侧CH4中C原子失去电子化合价升高转化为CO,被氧化,则氧化作用的物质为CH4,膜Ⅱ侧发生的电极反应式为CH4+ O2--2e-=CO+2H2;
(2)已知:①CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2=-49.0kJ/mol
②CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.1kJ/mol
根据盖斯定律:①+②可得CO(g)+2H2(g) CH3OH(g) △H1 =-90.1 kJ/mol;
(3)①在恒温恒压条件下发生反应:CO(g)+2H2(g) CH3OH(g)是气体体积减小的反应,增大压强,平衡向右移动,CO的转化率会增大,结合图1,保持温度不变转化率大的表示压强大,所以p1>p2;
M点时,CO的转化率为60%,则CO转化了1mol×60%=0.6mol,列“三段式”:
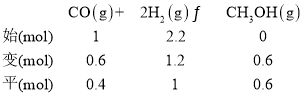
由上式可知平衡时的总物质的量=(0.4mol+0.6mol+1mol)=2mol,该反应的平衡常数Kp=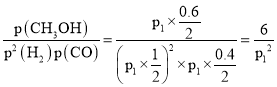 ;
;
②根据(2)分析,该反应放热,当温度越高时,平衡常数越小,则lgK也会越小,也就是说T与lgK呈反比关系,所以B、E两点符合lgK与温度(T)的关系;
(4)H2还原NO的反应为2NO(g)+2H2(g)N2(g)+2H2O(l),实验测得反应速率的表达式为v=k·cm(NO)·cn(H2)(k是速率常数,只与温度有关)。
①由编号1、编号2 组数据,保持c(H2)不变,则![]() ,代入1、2组数据,得
,代入1、2组数据,得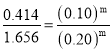 ,解得m=2,由编号2、编号3 组数据,保持c(N2)不变,则
,解得m=2,由编号2、编号3 组数据,保持c(N2)不变,则![]() ,代入2、3组数据,得
,代入2、3组数据,得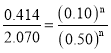 ,解得n=1;
,解得n=1;
②A.H2O2参与两个反应,但第一步未作反应物,因而不是催化剂,实际上H2O2仅是中间产物,故A错误;
B.总反应速率由慢反应决定,即由反应ⅰ的速率决定,故B错误;
C.反应ⅰ是慢反应,说明反应速率小,在其他条件一样的情况下,活化能较高,故C正确;
D.碰撞理论指出,能发生化学反应的碰撞是有效碰撞,即需要一定的能量和取向的碰撞,所以在所有的碰撞中只有部分碰撞是有效碰撞,故D正确;
答案选CD。

【题目】按要求回答下列问题。
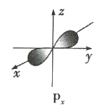
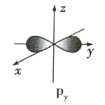
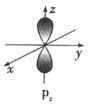
(1)下列基态原子或离子的电子排布式或轨道表示式正确的是_______(填序号,下同),违反能量最低原理的是_____,违反泡利不相容原理的是_____,违反洪特规则的是_______。
①Si:![]()
②Al:![]()
③Co3+最外层:![]()
④Mg2+:1s22s22p6
⑤Sc:1s22s22p63s23p63d3
⑥Cr:1s22s22p63s23p63d54s1
(2)物质:①甲烷 ②硫化氢 ③氢氧化镁 ④氨气 ⑤乙烯
条件 | 符合条件物质的序号 |
既含极性键又含非极性键 | ______ |
含有极性键的极性分子 | ______ |
上述分子中键角由大到小的顺序 | ______ |
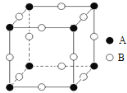
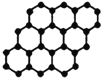
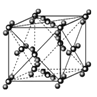
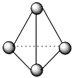
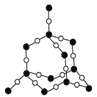
(3)甲图FeO晶胞中与Fe2+最近的Fe2+的个数为__________;乙图晶胞中A、B两种微粒个数比为______;丙图晶胞中A、B两种微粒个数比为_________。
甲.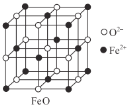 乙.
乙.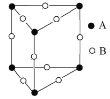 丙.
丙.