题目内容
【题目】工业上可通过煤的液化合成甲醇,主反应为:
CO(g)+2H2(g) ![]() CH3OH(1) △H=xkJ/mol
CH3OH(1) △H=xkJ/mol
(1)己知常温下CH3OH(1)、H2和CO的燃烧热分別为726.5kJ/mol、285.5kJ/mol、283.0kJ/mol,则x=___________;为提高合成甲醇反应的选择性,关键因素是___________。
(2)TK下,在容积为1.00L的某密闭容器中进行反应CO(g)+2H2(g) ![]() CH3OH(g) △H<0,相关数据如图。
CH3OH(g) △H<0,相关数据如图。
①该反应0~10min的平均速率υ(H2)___________mol/(L·min);M和N点的逆反应速率较大的是___________(填“υ逆(M)”、“υ逆(N)”或“不能确定”)。
②10min时容器内CO的体积分数为___________。
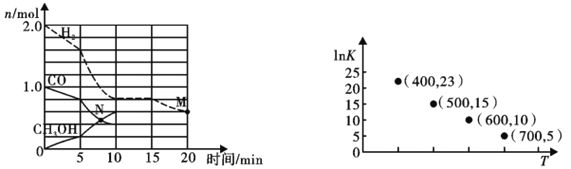
③对于气相反应,常用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)表示平衡常数(以Kp表示),其中PB=P总×B的体积分数。若在TK下平衡气体总压强为xMPa,则该反应的平衡常数Kp=___________(写出表达式,不必化简)。实验测得不同温度下的lnKp(化学平衡常数Kp的自然对数)如图,请分析lnKp随T呈现上述变化趋势的原因______________________。
【答案】-127.5 催化剂 0.12 不能确定 22.22% 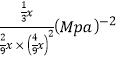 该反应正反应为放热反应,当温度升高平衡逆向移动,平衡常数(Kp或lnKp)减小。
该反应正反应为放热反应,当温度升高平衡逆向移动,平衡常数(Kp或lnKp)减小。
【解析】
(1)根据盖斯定律计算x值;根据催化剂具有选择性分析;(2) ①根据![]() 计算;N未平衡,反应正向进行, M点为平衡后反应正向移动的点,增大压强、减少生成物浓度都能使平衡正向移动; ②10min时容器内CO的体积分数为
计算;N未平衡,反应正向进行, M点为平衡后反应正向移动的点,增大压强、减少生成物浓度都能使平衡正向移动; ②10min时容器内CO的体积分数为![]() ;③根据Kp=P(CH3OH)/[P(CO)·P2(H2)] 计算;该反应正反应为放热反应,当温度升高平衡逆向移动。
;③根据Kp=P(CH3OH)/[P(CO)·P2(H2)] 计算;该反应正反应为放热反应,当温度升高平衡逆向移动。
(1)CO(g)燃烧的热化学方程式为CO(g)+1/2 O2(g)= CO2(g) ΔH=—283.0 kJ/mol ①; CH3OH(l) 燃烧的热化学方程式为CH3OH(l) +3/2 O2(g)= CO2(g)++ 2H2O(l) ΔH= —726.5 kJ/mol ②;H2(g)燃烧的热化学方程式为H2 (g)+1/2 O2(g)= H2O(l) ΔH=—285.5kJ/mol③;①+③![]() -②可得:CO(g)+2H2(g)
-②可得:CO(g)+2H2(g) ![]() CH3OH(1) ΔH=-127.5 kJ/mol;催化剂具有选择性,为提高合成甲醇反应的选择性,关键因素是选择合适的催化剂;
CH3OH(1) ΔH=-127.5 kJ/mol;催化剂具有选择性,为提高合成甲醇反应的选择性,关键因素是选择合适的催化剂;
(2) ①该反应0~10min的平均速率υ(H2)=![]() 0.12 mol/(L·min); N点未平衡,反应正向进行,υ逆(N)小于平衡时的逆反应速率,M点为平衡后反应正向移动的点,若增大压强使平衡正向移动,则υ逆(M)大于平衡时的逆反应速率,若减少生成物浓度使平衡正向移动,则υ逆(M)小于平衡时的逆反应速率;所以不能确定M和N点的逆反应速率大小;②10min时容器内CO的体积分数为
0.12 mol/(L·min); N点未平衡,反应正向进行,υ逆(N)小于平衡时的逆反应速率,M点为平衡后反应正向移动的点,若增大压强使平衡正向移动,则υ逆(M)大于平衡时的逆反应速率,若减少生成物浓度使平衡正向移动,则υ逆(M)小于平衡时的逆反应速率;所以不能确定M和N点的逆反应速率大小;②10min时容器内CO的体积分数为![]() 22.22%;
22.22%;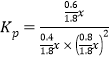 =
=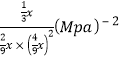 ;该反应正反应为放热反应,当温度升高平衡逆向移动,平衡常数(Kp或lnKp)减小。
;该反应正反应为放热反应,当温度升高平衡逆向移动,平衡常数(Kp或lnKp)减小。