题目内容
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验:
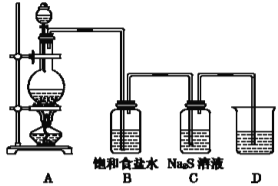
(1)装置A中制取的物质是___,化学方程式___。
(2)装置B的作用是___;C中的现象是___,离子方程式___,由此说明非金属性的强弱顺序是__。
(3)D中盛装的溶液是___,作用是___,离子方程式___。
【答案】Cl2 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 吸收HCl 变浑浊 S2-+Cl2=2Cl-+S↓ Cl>S NaOH溶液 吸收多余的Cl2 Cl2+2OH-=Cl-+ClO-+H2O
MnCl2+Cl2↑+2H2O 吸收HCl 变浑浊 S2-+Cl2=2Cl-+S↓ Cl>S NaOH溶液 吸收多余的Cl2 Cl2+2OH-=Cl-+ClO-+H2O
【解析】
为了验证氯元素的非金属性比硫元素的非金属性强,则装置A应为制取Cl2的装置,其中圆底烧瓶内放置MnO2,分液漏斗内放置浓盐酸;B装置为Cl2中HCl的除杂装置;C中为Cl2与Na2S发生置换反应,从而证明氯的非金属性比硫强的装置;D是尾气的处理装置。
(1)由以上分析可知,装置A中制取的物质是Cl2,发生MnO2与浓盐酸反应,生成MnCl2、Cl2等,化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。答案为:Cl2;MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O。答案为:Cl2;MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)装置B中放置饱和食盐水,是为了除去氯气中的氯化氢,所以其作用是吸收HCl;C中发生硫化钠与氯气的置换反应,生成硫和氯化钠,所以产生的现象是变浑浊(或有淡黄色沉淀生成),离子方程式为S2-+Cl2=2Cl-+S↓,由此说明非金属性的强弱顺序是Cl>S。答案为:吸收HCl;变浑浊;S2-+Cl2=2Cl-+S↓;Cl>S;
(3)D中盛装能吸收氯气的溶液,应是NaOH溶液,作用是吸收多余的Cl2,离子方程式为Cl2+2OH- =Cl-+ClO-+H2O。答案为:NaOH溶液;吸收多余的Cl2;Cl2+2OH-=Cl-+ClO-+H2O。