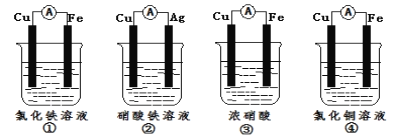
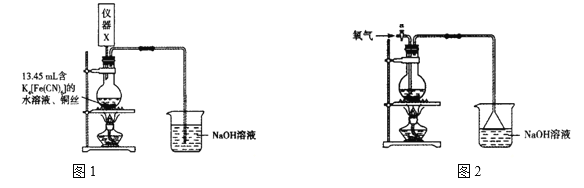
题目内容
【题目】图1是课本“还原铁粉与水蒸气反应”的实验装置图。
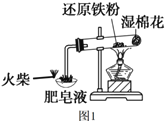
(1)铁粉与水蒸气反应的化学方程式是___。
(2)证明还原铁粉与水蒸气发生了反应的现象是___。
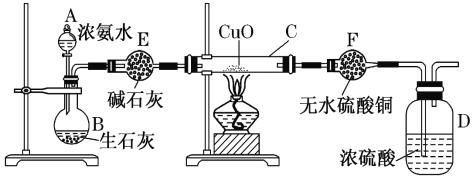
某同学设计图2装置进行“铁与水蒸气反应”的实验。(图中部分夹持及尾气处理装置略)
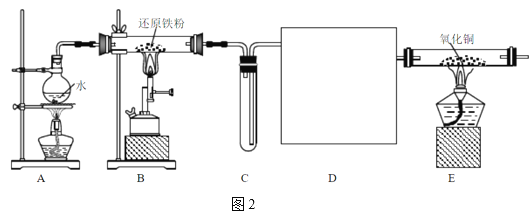
(3)图1装置中湿棉花的作用与图2中___(填“A、B、C、D、E”)装置的作用一样。
(4)装置D的作用是干燥氢气,请在方框内补充完整的装置和试剂___。
(5)实验结束,该同学取反应后装置B中固体混合物溶于足量稀硫酸,再向其中滴加几滴KSCN溶液,振荡,未见溶液变红,得出结论“反应后装置B中固体混合物”不含Fe3O4。你认为正确吗?为什么?你认为___,理由是___。
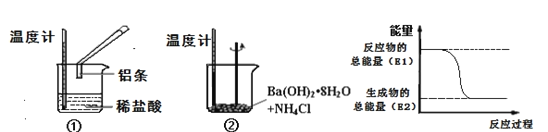
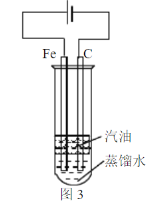
(6)某同学为实现“常温下铁与液态水的反应”设计了图3装置。实验中发现碳棒上冒气泡,蒸馏水中出现白色沉淀。书写该实验发生的化学方程式___。
【答案】3Fe+4H2O![]() Fe3O4+4H2 肥皂泡上升,点燃有爆鸣声 A
Fe3O4+4H2 肥皂泡上升,点燃有爆鸣声 A ![]() 不正确 如果反应后混合物中还有未反应的铁粉,铁粉会将溶液中的Fe3+全部还原为Fe2+,即便加KSCN溶液也不变红色 Fe+2H2O
不正确 如果反应后混合物中还有未反应的铁粉,铁粉会将溶液中的Fe3+全部还原为Fe2+,即便加KSCN溶液也不变红色 Fe+2H2O![]() Fe(OH)2↓+H2↑
Fe(OH)2↓+H2↑
【解析】
铁粉可以和水蒸气高温条件反应生成四氧化三铁和氢气,图1中湿棉花可以产生水蒸气,然后进行反应,生成的氢气会在肥皂液中吹出气泡,由于氢气的密度比空气小,气泡会上浮,且点燃有爆鸣声;图2中装置A可以受热产生水蒸气,进入装置B进行反应,装置C用向下排空气法收集氢气,为验证氢气的生成,可将其通过装置E与灼热的氧化铜反应,通入装置E前需先将氢气干燥,若有氢气生成可以将氧化铜还原成铜单质,可以看到黑色固体变为红色。
(1)Fe粉与水蒸气在高温下反应生成Fe3O4和氢气,方程式为:3Fe+4H2O(g)![]() Fe3O4+4H2;
Fe3O4+4H2;
(2)图1中若生成的气体会使肥皂泡上升,且点燃有爆鸣声,可以证明还原铁粉与水蒸气发生了反应;
(3)图1装置中湿棉花的作用是提供水得到与铁粉反应的水蒸气,图2中装置A提供水蒸气,与湿棉花的作用相同;
(4)氢气为中性气体,可以用浓硫酸或碱石灰干燥,若用碱石灰干燥,则装置如图![]() ;
;
(5)若反应后混合气体中还有未反应的铁粉,铁粉会将溶液中的Fe3+全部还原为Fe2+,即便滴加KSCN溶液也不会显红色,所以该说法不正确;
(6)实验中发现碳棒上冒气泡,根据铁粉与水蒸气的反应产物,可推测出该气体应为氢气;蒸馏水中出现白色沉淀,结合参与反应的几种物质所含的元素,只有Fe元素可以产生沉淀,而沉淀为白色,Fe(OH)3是红褐色沉淀,说明该沉淀应为Fe(OH)2,结合电子守恒和元素守恒可得方程式为Fe+2H2O![]() Fe(OH)2↓+H2↑。
Fe(OH)2↓+H2↑。