题目内容
【题目】某实验小组同学进行如下实验,以检验化学反应中的能量变化。
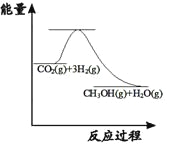
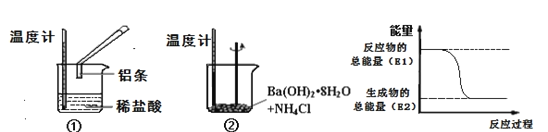
(1)实验中发现,反应后①中的温度升高;②中的温度降低。由此判断铝条与盐酸的反应是__热反应,Ba(OH)28H2O与NH4Cl反应时,需要将固体研细其目的是__,反应过程__(填“①”或“②”)的能量变化可用图表示。
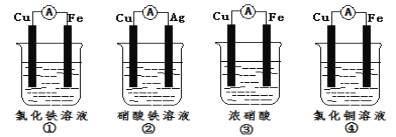
(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的是__(填序号)。
【答案】放 增大接触面积,提高反应速率 ① ②
【解析】
(1)实验中发现,反应后①中的温度升高,说明铝与盐酸反应过程中释放能量使温度升高,则该反应为放热反应;②中的温度降低,说明Ba(OH)28H2O与NH4Cl反应过程中吸收能量使体系温度降低,为吸热反应,反应时将固体研细可以使固体反应物充分接触,有利于提高化学反应速率;由图中的物质的能量变化可知反应物的总能量高于产物的总能量,为放热反应,因此可以表示①的能量变化,故答案为:放;增大接触面积,提高反应速率;①。
(2)为了验证Fe3+与Cu2+氧化性强弱,应利用的反应原理是:Cu+2Fe3+=Cu2++2Fe2+;①中铁比铜活泼,铁做负极,反应原理为Fe+2Fe3+=3Fe2+,不能验证Fe3+与Cu2+氧化性强弱;②铜比银活泼,铜做负极,反应原理为Cu+2Fe3+=Cu2++2Fe2+,可验证Fe3+与Cu2+氧化性强弱;③铁遇到浓硝酸发生钝化,实际是铜做负极,反应原理是铜与浓硝酸的反应,不能验证Fe3+与Cu2+氧化性强弱;④铁比铜活泼,铁做负极,电解质溶液是氯化铜,反应原理是Cu2++Fe=Cu+Fe2+,不能验证Fe3+与Cu2+氧化性强弱;因此可以达到目的的是②,故答案为:②。

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案
相关题目