题目内容
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
| | 操作 | 现象 | 结论 |
| A | 滴加BaC12溶液 | 生成白色沉淀 | 原溶液中有SO42― |
| B | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+无K+ |
| C | 滴加氯水和CC14,振荡、静置 | 下层溶液液显紫色 | 原溶液中有I― |
| D | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
C
解析试题分析:A项的结论错误,原溶液中可能含有:①SO42―、②SO32―、③Ag+、④SO42―和SO32―,因为SO32―、Ag+与BaC12溶液也能够发生复分解反应,且生成的BaSO3、AgCl都是白色沉淀,故A错误;B项的结论错误,因为没有透过蓝色钴玻璃片观察,不能确定原溶液中是否含有K+,故B错误;原溶液无色,说明不存在I2,氯水是重要的氧化剂,操作及现象说明有I2生成,说明一定发生反应:Cl2+2I―=2Cl―+I2,则结论正确,故C正确;D项的结论错误,稀溶液中发生的反应可能是NH4++OH―=NH3·H2O,因为没有加热,可能没有氨气逸出,因此试纸不变蓝不能说明原溶液中无NH4+,因为NH4+的浓度可能很小,故D错误。
考点:考查化学实验基本操作,主要涉及常见离子的检验方法,设计检验硫酸根离子、钾离子、钠离子、碘离子、铵根离子的方案时,需要注意排除某些离子的干扰。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下图所示的实验,能达到实验目的的是
| A | B | C | D |
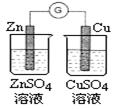 |  |  |  |
| 验证化学能转化为电能 | 验证温度对平衡移动的影响 | 验证铁发生析氢腐蚀 | 验证非金属性Cl> C > Si |
根据下列实验现象,所得结论错误的是 
| 实验 | 实验现象 | 结论 |
| A | Ⅰ烧杯中铁片表面有气泡,Ⅱ烧杯中铜片表面有气泡 | 活动性:Al>Fe>Cu |
| B | 试管中收集到无色气体 | 铜与浓硝酸反应产物是NO |
| C | 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
| D | 长颈漏斗内液面高于烧瓶内液面且保持不变 | 装置气密性良好 |
对实验Ⅰ~ Ⅳ的实验现象预测正确的是( )
| A.实验Ⅰ试管中红色溶液逐渐变成无色溶液 |
| B.实验Ⅱ试管中出现淡黄色浑浊 |
| C.实验Ⅲ铁棒上有无色气泡产生 |
| D.实验Ⅳ中酸性KMnO4溶液中出现气泡且颜色逐渐褪去 |
以下进行性质比较的实验设计,不合理的是
| A.比较Cu、Fe2+的还原性:Cu加入FeCl3溶液中 |
| B.比较氯、溴非金属性:氯气通入溴化钠溶液中 |
| C.比较镁、铝金属性:镁、铝(除氧化膜)分别放入4mol·L¯1NaOH溶液中 |
| D.比较高锰酸钾、氯气的氧化性:高锰酸钾中加入浓盐酸 |
下列图示实验合理的是
| A.图1为证明非金属性强弱:S>C>Si | B.图2为制备少量氧气 |
| C.图3为配制一定浓度硫酸溶液 | D.图4制备并收集少量NO2气体 |
下列实验能达到目的的是
| A.用锌与稀硝酸制备H2 |
| B.用酸性KMnO4溶液鉴别1-戊烯和甲苯 |
| C.用丁达尔效应鉴别鸡蛋白溶液和食盐水 |
| D.用水来除去NO2中少量的NO |
(14分)
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
(1) ①检查气体发生装置A的气密性的操作是:____________
②整套实验装置存在一处明显不足,请指出_____________.
(2) 用改正后的装置进行实验.实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯 | D装置中:溶液变红 E装置中:水层溶液变黄振荡后CCl4层无明显变化 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: ______________________ |
D装置中:红色慢慢褪去。E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深最后变成红色。为探究上述实验现象的本质,小组同学查得资料如下:
| Ⅰ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2. Ⅱ.Cl2和Br2反应生成BrCl,它呈红色(略带黄色),沸点为5℃,与水发生水解反应. Ⅲ.AgClO、AgBrO均可溶于水. |
② 欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合化学用语解释仅产生白色沉淀的原因_______________________________________________
③将少量BrCl通入到碘化钾溶液中,该反应的化学方程式为:___________________
下列对实验现象的解释与结论,正确的是( )
| 选项 | 实验操作 | 实验现象 | 解释与结论 |
| A | 向鸡蛋清溶液中加入饱和(NH4)2SO4溶液 | 有白色沉淀产生 | 蛋白质发生了变性 |
| B | 向某溶液中加入盐酸酸化的BaCl2溶液 | 有白色沉淀产生 | 该溶液中一定含有SO42- |
| C | 向甲苯中滴入少量浓溴水,振荡,静置 | 溶液分层,上层呈橙红色,下层几乎无色 | 甲苯和溴水发生取代反应,使溴水褪色 |
| D | 向蔗糖中加入浓硫酸 | 变黑,放热,体积膨胀,放出刺激性气体 | 浓硫酸具有脱水性和强氧化性,反应中生成C、SO2和CO2等 |