题目内容
以下进行性质比较的实验设计,不合理的是
| A.比较Cu、Fe2+的还原性:Cu加入FeCl3溶液中 |
| B.比较氯、溴非金属性:氯气通入溴化钠溶液中 |
| C.比较镁、铝金属性:镁、铝(除氧化膜)分别放入4mol·L¯1NaOH溶液中 |
| D.比较高锰酸钾、氯气的氧化性:高锰酸钾中加入浓盐酸 |
C
解析试题分析:若溶液变蓝,说明氯化铁能腐蚀单质铜,则Cu是还原剂、Fe3+是氧化剂、Fe2+是还原产物,由于该反应中还原剂的还原性大于还原产物,因此能比较Cu、Fe2+的还原性,故A合理;若无色溶液变为淡黄色,说明氯气能从盐中置换出单质溴,则氯气是氧化剂、溴离子是还原剂、单质溴是氧化产物,由于该反应中氧化剂的氧化性大于氧化产物,则单质氯的氧化性大于单质溴,所以氯元素的非金属性比溴强,故B合理;元素金属性强弱可以从其单质与酸反应置换出氢的难易程度,因此将镁、铝(除氧化膜)分别放入稀盐酸或稀硫酸中,根据置换出氢的难易程度可以比较镁、铝金属性,故C不合理;若产生黄绿色气体,说明高锰酸钾能氧化HCl,则高锰酸钾是氧化剂、HCl是还原剂、氯气是氧化产物,由于该反应中氧化剂的氧化性大于氧化产物,因此能比较高锰酸钾、氯气的氧化性,故D合理。
考点:考查化学实验方案的设计与评价,涉及铁盐的氧化性、卤素单质的氧化性、镁铝的金属性、高锰酸钾和氯气的氧化性等。

下列叙述正确的是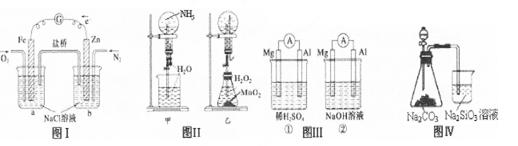
| A.图I装置中通入N2和O2的作用是相同的 |
| B.图Ⅱ中甲、乙两装置产生喷泉的原理一样 |
| C.图Ⅲ①装置中镁片是原电池的负极;②装置中镁片是原电池的正极 |
| D.图Ⅳ分液漏斗盛硝酸能证明非金属性N>C>Si,盛硫酸能证明非金属性S>C>Si |
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
| | 操作 | 现象 | 结论 |
| A | 滴加BaC12溶液 | 生成白色沉淀 | 原溶液中有SO42― |
| B | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+无K+ |
| C | 滴加氯水和CC14,振荡、静置 | 下层溶液液显紫色 | 原溶液中有I― |
| D | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
下述实验能达到预期目的的是
| 编号 | 实验内容 | 实验目的 |
| A | 将CO2(含HC1杂质)通入饱和NaHCO3溶液中 | 除去HC1 |
| B | 向做完银镜反应后的试管中加入稀氨水 | 除去试管内残留物 |
| C | 向做完淀粉水解后的溶液中直接加入新制的Cu(OH)2,并加热 | 检验淀粉是否水解 |
| D | 将少量FeC12试样加水溶解,加稀硝酸酸化,再滴加KSCN溶液 | 检验FeCl2是否变质 |
下列实验正确的是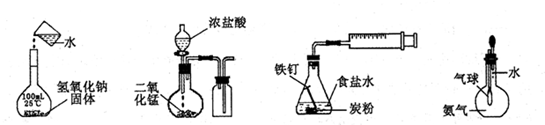
| A.配制一定浓度溶液 | B.制取并收集Cl2 | C.铁的析氢腐蚀 | D.验证氨气易溶于水 |
(16分)某化学兴趣小组在进行钠在空气中燃烧的实验,请写出钠在氧气中燃烧的化学方程式: 。实验后,同学们发现除了得到黄色物质外,产物中还有黑色物质。兴趣小组的同学对产生的黑色固体物质进行实验探究。
查阅资料:
工业上采用铁环作阴极电解得到金属钠。实验室中金属钠的标签主要内容如下: 
提出猜想:
猜想1:钠附着煤油,煤油的不完全燃烧可以生成碳单质;猜想2: 与钠反应也可以生成碳单质;
猜想3: ; 猜想4:……
设计实验方案,验证猜想:
| 实验目的 | 实验步骤 | 实验现象 | 结论 |
| 验证猜想1 | 将一小块钠从煤油中直接取出加热燃烧 取出一小块切去表皮并擦干净煤油的钠加热燃烧 | | 黑色物质中含 有碳单质 |
| 验证猜想3 | | | 黑色物质中 含有铁元素 |
同学们了解到金属钠在石棉网上燃烧,与石棉网作用也可以生成含铁的黑色物质,请你评价钠在石棉网上燃烧探究其在空气中燃烧产物是否合理并说明原因: 。
请设计实验验证猜想2(不要求写具体操作过程): 。
下列根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 取等物质的量的两种金属单质X、Y,分别与足量的盐酸反应 | X产生氢气的体积比Y多 | 金属性:X>Y |
| B | 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | HA放出的氢气多且反应速率快 | HA酸性比HB强 |
| C | 在CuSO4溶液中加入KI溶液,再加入苯,振荡 | 有白色沉淀生成,苯层呈紫色 | 白色沉淀可能为CuI |
| D | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
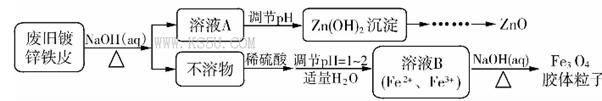
 Fe3O4(胶体)+S4O62-+H2O
Fe3O4(胶体)+S4O62-+H2O