题目内容
3.硫及其化合物有广泛应用.(1)硫酸生产过程中涉及以下反应.已知25℃、l0l kPa时:
2SO2(g)+O2(g)+2H2O(l)═2H2SO4(l)△H=-457kJ•mol-1
SO3(g)+H2O(l)═H2SO4(l)△H=-130kJ•mol-1
则SO2催化氧化反应中,每生成l mol SO3(g)的焓变为-98.5kJ•mol-1
(2)对于SO3催化氧化反应:2SO2(g)+O2(g)?2SO3(g).
①甲图是SO2催化氧化反应时SO2(g)和SO3(g)的浓度随时间的变化情况.反应从开始到达到平衡时,用O2表示的平均反应速率为0.0375mol/(L.min).

②在一容积可变的密闭容器中充入20molSO2(g)和l0molO2(g),O2的平衡转化率随温度(T)、压强(P)的变化如图乙所示.则P1与P2的大小关系是P1< P2(填>、=或<);A、B、C三点的平衡常数大小关系是KA=KB>KC(用KA、KB、KC和>、=、<表示).
(3)为研究H2SO4生产中SO3催化氧化时温度对SO2平衡转化率的影响,进行如下试验.取100L原料气(体积分数为SO27%、O2 11%、N282%)使之发生反应,在10l kPa下达到平衡,得到如下数据:
| 温度/℃ | 500 | 525 | 550 | 575 | 600 |
| 平衡转化率/% | 93.5 | 90.5 | 85.6 | 80.0 | 73.7 |
(4)工业生成硫酸过程中,通常用氨水吸收尾气.
①如果相同物质的量的SO2与NH3溶于水,发生反应的离子方程式为SO2+NH3+H2O=NH4++HSO3-,所得溶液中c(H+)-c(OH-)=cd(填序号).
a.c(SO32-)-c(H2SO3)
b.c(HSO3-)+c(SO32-)-c(NH4+)
c.c(SO32-)+c(NH3•H2O)-c(H2SO3)
d.c(HSO3-)+2c(SO32-)-c(NH4+)
②工业上用足量氨水吸收硫酸工业废气.吸收SO2后的碱性溶液还可用于Cl2的尾气处理,吸收Cl2后的溶液仍呈强碱性,则吸收Cl2后的溶液中一定存在的阴离子有OH-和Cl-、SO42-.
分析 (1)已知:①.2SO2(g)+O2(g)+2H2O(l)═2H2SO4(l)△H=-457kJ•mol-1
②.SO3(g)+H2O(l)═H2SO4(l)△H=-130kJ•mol-1
根据盖斯定律,①-2×②可得:2SO2(g)+O2(g)═2SO3(g)△H=-197kJ•mol-1,进而计算每生成l mol SO3(g)的焓变;
(2)①根据v=$\frac{△c}{△t}$计算v(SO3),再利用速率之比等于化学计量数之比计算v(O2);
②正反应为气体体积减小的反应,增大压强,平衡向正反应方向移动,氧气的转化率增大;
平衡常数只受温度影响,与压强无关,正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小;
(3)结合二氧化硫的转化率计算平衡时各组分的体积,进而计算SO3的体积分数;
(4)①同物质的量的SO2与NH3溶于水,发生反应生成亚硫酸氢铵;
根据电荷守恒,可知:c(H+)+c(NH4+)=c(HSO3-)+2c(SO32-)+c(OH-),溶液中氢离子源于水电离、HSO3-的水解、NH4+的水解,氢氧根离子源于水的电离、HSO3-的水解,由水电离得到的c水(H+)与c水(OH-)相等,据此判断;
②吸收Cl2后的溶液仍呈强碱性,说明有大量OH-,氯气能将亚硫酸根氧化为硫酸根,自身被还原为氯离子.
解答 解:(1)已知:①.2SO2(g)+O2(g)+2H2O(l)═2H2SO4(l)△H=-457kJ•mol-1
②.SO3(g)+H2O(l)═H2SO4(l)△H=-130kJ•mol-1
根据盖斯定律,①-2×②可得:2SO2(g)+O2(g)═2SO3(g)△H=-197kJ•mol-1,故每生成l mol SO3(g)的△H=(-197kJ•mol-1)×$\frac{1}{2}$=-98.5kJ•mol-1,
故答案为:-98.5;
(2)①v(SO3)=$\frac{0.75mol/L}{10min}$=0.075mol/(L.min),速率之比等于化学计量数之比,则v(O2)=$\frac{1}{2}$v(SO3)=$\frac{1}{2}$×0.075mol/(L.min)=0.0375mol/(L.min),
故答案为:0.0375mol/(L.min);
②正反应为气体体积减小的反应,增大压强,平衡向正反应方向移动,氧气的转化率增大,故压强P1<P2;
平衡常数只受温度影响,与压强无关,正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,故平衡常数:KA=KB>KC,
故答案为:<;KA=KB>KC;
(3)参加反应二氧化硫为:100L×7%×80%=5.6L,
2SO2(g)+O2(g)═2SO3(g)
开始(L):7 11 0
转化(L):5.6 2.8 5.6
平衡(L):1.4 8.2 5.6
故平衡时SO3的体积分数为$\frac{5.6L}{1.4L+8.2L+5.6L+100L×82%}$×100%≈5.8%,
故答案为:5.8;
(4)①同物质的量的SO2与NH3溶于水,发生反应生成亚硫酸氢铵,反应离子方程式为:SO2+NH3+H2O=NH4++HSO3-;
根据电荷守恒,可知:c(H+)+c(NH4+)=c(HSO3-)+2c(SO32-)+c(OH-),则c(H+)-c(OH-)=c(HSO3-)+2c(SO32-)-c(NH4+)
溶液中氢离子源于水电离、HSO3-的水解、NH4+的水解,氢氧根离子源于水的电离、HSO3-的水解,由水电离得到的c水(H+)与c水(OH-)相等,则c(H+)-c(OH-)=[c(SO32-)+c(NH3•H2O)+c水(H+)]-[c(H2SO3)+c水(OH-)]=c(SO32-)+c(NH3•H2O)-c(H2SO3),故cd正确,
故答案为:SO2+NH3+H2O=NH4++HSO3-;cd;
②吸收Cl2后的溶液仍呈强碱性,说明有大量OH-,氯气能将亚硫酸根氧化为硫酸根,自身被还原为氯离子,则吸收Cl2后的溶液中一定存在的阴离子有OH-和Cl-、SO42-,
故答案为:Cl-、SO42-.
点评 本题反应热有关计算、反应速率计算、化学平衡计算、化学平衡图象、离子浓度大小比较等,属于拼合型题目,(4)中离子浓度判断为易错点、难点,注意利用电荷守恒、电离与水解进行分析解答.

 阅读快车系列答案
阅读快车系列答案| 选项 | A | B | C | D |
| 图标 | 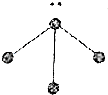 | 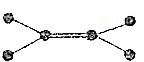 | 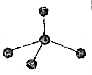 |  |
| 化学式 | NH3 | C2H4 | CCl4 | CO2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | W-的离子半径大于Z3+的离子半径 | |
| B. | W、X形成的化合物为离子化合物 | |
| C. | X的最高价氧化物对应的水化物的酸性比W的强 | |
| D. | Y的气态简单氢化物的稳定性比X的强 |
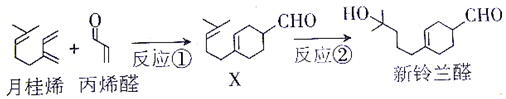
| A. | 反应①属于加成反应 | |
| B. | 新铃兰醛能发生消去反应 | |
| C. | 检验新铃兰醛中是否混有醛X,可用溴水 | |
| D. | 1mol新铃兰醛完全燃烧需消耗17.5mol O2 |
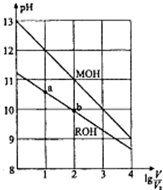 浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )
| A. | MOH的碱性弱于ROH的碱性 | |
| B. | ROH的电离平衡常数:b点大于a点 | |
| C. | 若两溶液无限稀释,则它们的c(OH-)不相等 | |
| D. | 当lg$\frac{V}{{V}_{0}}$=2时,若两溶液同时升高温度,则$\frac{c({M}^{+})}{c({R}^{+})}$减小 |
| A. | 淀粉、纤维素、蛋白质都是天然高分子化合物 | |
| B. | 用于奥运“祥云”火炬的丙烷是一种清洁燃料 | |
| C. | 纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 | |
| D. | 用大米酿的酒在一定条件下密封保存,时间越长越香醇 |
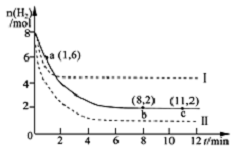 工业上可用CO2生产甲醇,反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).将6molCO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示.图中虚线表示仅改变某一反应条件时,H2物质的量随时间的变化.下列说法正确的是( )
工业上可用CO2生产甲醇,反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).将6molCO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示.图中虚线表示仅改变某一反应条件时,H2物质的量随时间的变化.下列说法正确的是( )| A. | 反应开始至a点时v(H2)=2mol•L-1•min-1 | |
| B. | 若曲线I对应的条件改变是升高温度,则该反应△H>0 | |
| C. | 曲线II对应的条件改变是降低压强 | |
| D. | 保持温度不变,若将平衡后的容器体积缩小至1L,重新达平衡时则2 mol•L-1<c(CH3OH)<8/3 mol•L-1 |