��Ŀ����
13����1��д����ʾ����8�����ӣ�10�����ӵ�ԭ�ӵĻ�ѧ���ţ�188O����2����֪������aX2-��������bYn+������ͬ�ĺ�������Ų�����a��b��n֮��Ĺ�ϵΪa=b-n-2��
��3���Ƚ����д�С���������������
A��ԭ�Ӱ뾶��Cl��Na B�� ���ԣ�H2CO3��H2SiO3��
��4��ijԪ��R��̬�⻯����Ļ�ѧʽRH3��������������к���20/27����֪��Ԫ�ص�ԭ�Ӻ�������������������ȣ����Ԫ�ص������ǵ���
��5����ӦA+3B�T2C+2D�����ֲ�ͬ������µķ�Ӧ���ʷֱ����£��÷�Ӧ���еĿ���˳��Ϊ�ۣ��ܣ��ڣ��٣�
��V��A��=0.15mol/��L•S�� ��V��B��=0.6mol/��L•S��
��V��C��=0.5mol/��L•S�� ��V��D��=0.45mol/��L•S��
���� ��1��ԭ�ӷ���ZAX�����½�ZΪ�����������Ͻ�AΪ��������XΪԪ�ط��ţ�����������=������+��������
��2����������aX2-��bXn+������ͬ�ĺ�������Ų���˵�������������ͬ���ݴ˽��
��3��ͬ�����������ԭ�Ӱ뾶��С��ͬ�������϶��·ǽ����Լ���������������Ӧˮ��������Լ�����
��4��Ԫ��R��̬�⻯����Ļ�ѧʽRH3����R��������ϼ�Ϊ-3������������ϼ�Ϊ+5�����������ΪR2O5����Ϻ���������R�����ԭ������������ȷ����Ԫ�أ�
��5����������֮�ȵ��ڻ�ѧ������֮�ȣ�����Ӧ������B��C��D��ʾ��ȫ��ת��Ϊ��A��ʾ���ݴ��жϣ�
��� �⣺��1������8�����ӵ�ԭ��ΪOԭ�ӣ�ԭ�Ӻ���10�����ӣ���������=10+8=18���ʸú��صķ���Ϊ��818O��
�ʴ�Ϊ��818O��
��2����������aX2-��bXn+������ͬ�ĺ�������Ų���˵�������������ͬ����a+2=b-n��������a=b-n-2��
�ʴ�Ϊ��b-n-2��
��3��ͬ�����������ԭ�Ӱ뾶��С����ԭ�Ӱ뾶Cl��Na��ͬ�������϶��·ǽ����Լ���������������Ӧˮ��������Լ�����������H2CO3��H2SiO3��
�ʴ�Ϊ����������
��4��Ԫ��R��̬�⻯����Ļ�ѧʽRH3����R��������ϼ�Ϊ-3������������ϼ�Ϊ+5�����������ΪR2O5����R�����ԭ������Ϊa����2a��80=��1-$\frac{20}{17}$����$\frac{20}{17}$�����a=14��Ԫ�ص�ԭ�Ӻ�������������������ȣ��ʸ�Ԫ��������Ϊ7���ʸ�Ԫ��ΪNԪ�أ�
�ʴ�Ϊ������
��5������Ӧ������B��C��D��ʾ��ȫ��ת��Ϊ��A��ʾ�������v��A��=0.2 mol/��L•s��������v��A��=0.25 mol/��L•s��������v��A��=0.225 mol/��L•s�������Կ���˳��Ϊ�ۣ��ܣ��ڣ��٣�
�ʴ�Ϊ���ۣ��ܣ��ڣ��٣�
���� ���⿼��ԭ�ӽṹ��Ԫ�������ɡ�Ԫ���ƶϡ���Ӧ���ʿ����Ƚϵȣ��ѶȲ����ضԻ���֪ʶ�Ĺ��̣�

 ������ȫ��������ϵ�д�
������ȫ��������ϵ�д�| A�� | ��S��0 | B�� | ��S��0 | C�� | ��S=0 | D�� | ��ȷ�� |
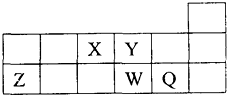
| A�� | ����Y2һ��Z3+�ĺ���������ͺ�������������ͬ | |
| B�� | ԭ�Ӱ뾶�Ĵ�С˳��Ϊ��r��Z����r��W����r��Q����r��Y����r��X�� | |
| C�� | ����������Ӧ��ˮ��������ԣ�W��Q | |
| D�� | Ԫ��X��Ԫ��Z����������ϼ���ֵ֮�͵���8 |
| A�� | ����Ͷ�뵽����NaOH��Һ�У�2Al+2OH-�T2AlO2-+H2�� | |
| B�� | ������ˮ��Ӧ��Cl2+H2O�T2H++Cl-+ClO- | |
| C�� | AlCl3��Һ�м��������İ�ˮ��Al3++3OH-�TAl��OH��3�� | |
| D�� | ���ۼ������Ȼ�����Һ�У�2Fe+Fe3+�T3Fe2+ |
| A�� | HI��H2��I2��Ũ������Ҳ��ٸı�ʱ | B�� | ����������ɫ��dz���ٱ仯ʱ | ||
| C�� | ��������ƽ��Ħ����������ʱ | D�� | v��HI����v��H2����v��I2��=2��1��1ʱ |
| A�� | �����ȥˮ����2H++CaCO3�TCa2++CO2��+H2O | |
| B�� | MnO2 ��Ũ���ᷴӦ��Cl2��MnO2+4HCl$\frac{\underline{\;\;��\;\;}}{\;}$Mn2++2Cl-+Cl2��+2H2O | |
| C�� | Na��ˮ����H2��Na+H2O�TNa++OH-+H2�� | |
| D�� | Ca��HCO3��2��Һ������NaOH��Һ��Ӧ��HCO3-+Ca2++OH-�TCaCO3��+H2O |
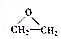 ��Ϊ�������飬����һ�������£���������������ӳɷ�Ӧ����ԭ�Ӽӵ���ԭ���ϣ��������ּ���̼ԭ���ϣ����жԻ��������������
��Ϊ�������飬����һ�������£���������������ӳɷ�Ӧ����ԭ�Ӽӵ���ԭ���ϣ��������ּ���̼ԭ���ϣ����жԻ��������������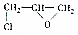 ��������ȷ���ǣ�������
��������ȷ���ǣ�������| A�� | ����ˮ��Ӧ����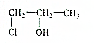 | |
| B�� | �ܼ���ˮ������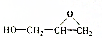 | |
| C�� | ��һ�������¿��Ժϳɸ��� | |
| D�� | ����AgNO3��Һ����������������İ�ɫ���� |
��1�����������������漰���·�Ӧ����֪25�桢l0l kPaʱ��
2SO2��g��+O2��g��+2H2O��l���T2H2SO4��l����H=-457kJ•mol-1
SO3��g��+H2O��l���TH2SO4��l����H=-130kJ•mol-1
��SO2��������Ӧ�У�ÿ����l mol SO3��g�����ʱ�Ϊ-98.5kJ•mol-1
��2������SO3��������Ӧ��2SO2��g��+O2��g��?2SO3��g����
�ټ�ͼ��SO2��������ӦʱSO2��g����SO3��g����Ũ����ʱ��ı仯�������Ӧ�ӿ�ʼ���ﵽƽ��ʱ����O2��ʾ��ƽ����Ӧ����Ϊ0.0375mol/��L��min����

����һ�ݻ��ɱ���ܱ������г���20molSO2��g����l0molO2��g����O2��ƽ��ת�������¶ȣ�T����ѹǿ��P���ı仯��ͼ����ʾ����P1��P2�Ĵ�С��ϵ��P1�� P2�����=����A��B��C�����ƽ�ⳣ����С��ϵ��KA=KB��KC����KA��KB��KC�ͣ���=������ʾ����
��3��Ϊ�о�H2SO4������SO3������ʱ�¶ȶ�SO2ƽ��ת���ʵ�Ӱ�죬�����������飮ȡ100Lԭ�������������ΪSO27%��O2 11%��N282%��ʹ֮������Ӧ����10l kPa�´ﵽƽ�⣬�õ��������ݣ�
| �¶�/�� | 500 | 525 | 550 | 575 | 600 |
| ƽ��ת����/% | 93.5 | 90.5 | 85.6 | 80.0 | 73.7 |
��4����ҵ������������У�ͨ���ð�ˮ����β����
�������ͬ���ʵ�����SO2��NH3����ˮ��������Ӧ�����ӷ���ʽΪSO2+NH3+H2O=NH4++HSO3-��������Һ��c��H+��-c��OH-��=cd������ţ���
a��c��SO32-��-c��H2SO3��
b��c��HSO3-��+c��SO32-��-c��NH4+��
c��c��SO32-��+c��NH3•H2O��-c��H2SO3��
d��c��HSO3-��+2c��SO32-��-c��NH4+��
�ڹ�ҵ����������ˮ�������Ṥҵ����������SO2��ļ�����Һ��������Cl2��β������������Cl2�����Һ�Գ�ǿ���ԣ�������Cl2�����Һ��һ�����ڵ���������OH-��Cl-��SO42-��