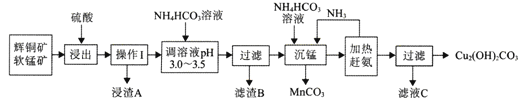
题目内容
【题目】在一定体积的密闭容器中,进行如下化学反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),不同温度下达到平衡时,反应体系中各物质的浓度如下表:
CO(g)+3H2(g),不同温度下达到平衡时,反应体系中各物质的浓度如下表:
温度 | CH4(g) | H2O(g) | CO(g) | H2(g) |
500K | 0.8mol/L | 0.8mol/L | 0.2mol/L | 0.6mol/L |
800K | 0.6mol/L | 0.6mol/L | 0.4mol/L | 1.2mol/L |
1000K | 0.4mol/L | 0.4mol/L | 0.6mol/L | 1.8mol/L |
(1)该反应的平衡常数表达式为K=______________,正反应为_________反应(填放热、吸热)。
(2)能判断该反应是否已达到化学平衡状态的依据是_________
a.容器压强不变 b.c(CH4)=c(H2O)
c.v正(CH4)=v逆(H2) d .混合气体中c(CO)不变
氮化铝是共价键化合物,高碳热还原制备氮化铝的总反应化学方程式为(未配平):
Al2O3(s)+C(s)+N2(g)→AlN(s)+CO(g) ……①
某氮化铝样品中含有氧化铝杂质.已知氮化铝和NaOH溶液能反应,并产生氨气,其反应方程式为:AlN+NaOH+H2O→NaAlO2+NH3↑……②,
氧化铝也能与氢氧化钠溶液反应而全部溶解……③
(3)配平化学化学方程式①:___Al2O3(s)+ C(s)+ N2(g)→ AlN(s)+ CO(g)
(4)反应②中产生气体的检验方法为____________________________________________;
反应③的离子方程式___________________________________________________________。
【答案】 c(CO)c(H2)3/c(CH4)c(H2O) 吸热 ad 1Al2O3(s)+3C(s)+1N2(g)→2AlN(s)+3CO(g) 湿润的红色石蕊试纸检验,试纸变蓝证明有氨气(或用玻璃棒蘸浓盐酸或者浓硝酸靠近,产生白烟,证明有氨气) Al2O3 + 2OH–=2AlO2– +H2O
【解析】(1)本题考查化学平衡常数的计算以及影响化学平衡常数的因素,根据化学平衡常数的定义,K=c3(H2)×c(CO)/[c(CH4)×c(H2O)],当温度等于500K时,K=0.63×0.2/0.82=0.0675,800K时,K=1.23×0.4/0.62=1.92,温度升高,化学平衡常数增大,说明温度升高,平衡向正反应方向移动,即正反应方向是吸热反应;(2)a、反应前后气体系数之和不相等,因此当压强不变时,说明反应达到平衡,故a正确;b、CH4和H2O的系数相等,开始时如果充入的CO2和H2O的量相同,则反应任何时刻两者浓度都相等,因此c(CH4)=c(H2O)时不能说明反应达到平衡,故b错误;c、用不同物质的反应速率判断达到平衡,要求反应方向一正一逆,且反应速率之比等于化学计量数之比,即3v正(CH4)=v逆(H2) ,故c错误;d、根据化学平衡状态的定义,当组分的浓度不再改变,说明反应达到平衡,故d正确;(3)根据反应方程式,C的化合价由0价→+2价,化合价升高2价,N的化合价降低,由0价→-3价,N2整体化合价降低6价,最小公倍数为6,然后根据原子守恒配平其他,即反应方程式为Al2O3(s)+3C(s)+N2(g)=2AlN(s)+3CO(g);(4)②中的气体为NH3,检验氨气常利用其水溶液显碱性,即湿润的红色石蕊试纸检验,试纸变蓝证明有氨气,或者NH3和挥发性酸反应生成白烟,即用玻璃棒蘸浓盐酸或者浓硝酸靠近,产生白烟,证明有氨气;反应③中氧化铝表现两性,即离子反应方程式为Al2O3+2OH-=2AlO2-+H2O。