题目内容
【题目】辉铜矿是铜矿的主要品种之一传统的火法冶炼在资源的综合利用、环境保护等方面会遇到困难。辉铜矿的湿法冶炼目前国内外都处于探索阶段。自氧化还氨氮分离法是一种较为理想的湿法冶炼方法,工艺流程如下图所示:
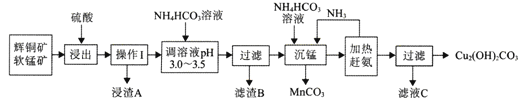
已知:
① 辉铜矿的主要成分是Cu2S,含有较多的Fe2O3、SiO2等。
② 软锰矿的主要成分是MnO2,含有较多的SiO2等。
③ 浸出时,生成一种非金属单质。
④ 室温下,Kap[Fe(OH)3]=4.0×10-38mol/L,Kap[Fe(OH)2]=8.0×10-16mol/L
完成下列填空:
(l)浸出前需要先将矿石粉碎,其目的是__________。
(2)写山浸出时主要反应的离子方程式_____________。
(3)浸渣A的主要成分为_______;调溶液pH 3.0-3.5的目的是除去______离子;室温下,若该离子的浓度为4.0×10-8mol/L,则溶液的pH=__________。
(4) 工业上可将MnCO3、在300℃左右氧化来制取具有较好催化性能的MnO2,则MnCO3在空气中受热制取MnO2的化学方程式为_________________。
(5)从滤液C中提取硫酸氨晶体的步骤为_______、_______、过滤、洗涤、干操。
(6)与火法冶炼辉铜矿相比,用图中方法冶炼辉铜矿的优点有________、_____。(列举其中2条)
【答案】 增大与酸的接触面积,加快反应速率(或提高浸出效率)(合理即可) Cu2S+2MnO2+8H+=Cu2++S+2Mn2++4H2O SiO2、S Fe3+ 4 2MnCO3+O2![]() 2MnO2+2CO2 蒸发浓缩 冷却结晶 实现资源的综合利用 不产生污染环境的气体、能耗低等(合理即可)
2MnO2+2CO2 蒸发浓缩 冷却结晶 实现资源的综合利用 不产生污染环境的气体、能耗低等(合理即可)
【解析】(1)酸浸时矿石颗粒大小影响浸取速率;(2)根据信息,MnO2能将金属硫化物中的硫氧化为单质硫,反应物是Cu2S、MnO2、H2SO4,生成物是CuSO4、MnSO4、S;(3)根据金属阳离子生成氢氧化物沉淀的pH范围判断;根据氢氧化铁的溶度积计算氢离子浓度,再计算PH; (4)MnCO3、氧气在300℃左右反应生成MnO2、二氧化碳;(5)从溶液获得晶体的步骤为蒸发浓缩、冷却结晶过、滤、洗涤、干操;;(6) 火法冶炼辉铜矿生成二氧化硫气体。
解析:(1)将矿石粉碎能增大与酸的接触面积,加快反应速率;(2)根据信息,MnO2能将金属硫化物中的硫氧化为单质硫,反应物是Cu2S、MnO2、H2SO4,生成物是CuSO4、MnSO4、S,把硫化亚铜看成整体,化合价变化是:(1×2+2×1)=4,Mn元素化合价变化是:4-2=2,根据化合价升降规律,浸出时主要反应的离子方程式Cu2S+2MnO2+8H+=Cu2++S+2Mn2++4H2O;(3)
SiO2与硫酸不反应,浸渣A的主要成分为SiO2,还有浸出反应生成的S单质;根据金属阳离子生成氢氧化物沉淀的pH范围使Fe3+完全沉淀且Cu2+不沉淀的PH范围是:3.2~4.4,故选择PH=4目的是使Fe3+完全水解生成氢氧化铁沉淀;根据氢氧化铁的溶度积![]() ,
, ![]() ,所以PH=4; (4)MnCO3、氧气在300℃左右反应生成MnO2、二氧化碳,方程式为2MnCO3+O2
,所以PH=4; (4)MnCO3、氧气在300℃左右反应生成MnO2、二氧化碳,方程式为2MnCO3+O2![]() 2MnO2+2CO2 ;(5)从溶液获得晶体的步骤为蒸发浓缩、冷却结晶过、滤、洗涤、干操;(6) 火法冶炼辉铜矿生成二氧化硫气体,用图中方法不产生污染环境的气体、能耗低。
2MnO2+2CO2 ;(5)从溶液获得晶体的步骤为蒸发浓缩、冷却结晶过、滤、洗涤、干操;(6) 火法冶炼辉铜矿生成二氧化硫气体,用图中方法不产生污染环境的气体、能耗低。

 名校课堂系列答案
名校课堂系列答案【题目】在一定体积的密闭容器中,进行如下化学反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),不同温度下达到平衡时,反应体系中各物质的浓度如下表:
CO(g)+3H2(g),不同温度下达到平衡时,反应体系中各物质的浓度如下表:
温度 | CH4(g) | H2O(g) | CO(g) | H2(g) |
500K | 0.8mol/L | 0.8mol/L | 0.2mol/L | 0.6mol/L |
800K | 0.6mol/L | 0.6mol/L | 0.4mol/L | 1.2mol/L |
1000K | 0.4mol/L | 0.4mol/L | 0.6mol/L | 1.8mol/L |
(1)该反应的平衡常数表达式为K=______________,正反应为_________反应(填放热、吸热)。
(2)能判断该反应是否已达到化学平衡状态的依据是_________
a.容器压强不变 b.c(CH4)=c(H2O)
c.v正(CH4)=v逆(H2) d .混合气体中c(CO)不变
氮化铝是共价键化合物,高碳热还原制备氮化铝的总反应化学方程式为(未配平):
Al2O3(s)+C(s)+N2(g)→AlN(s)+CO(g) ……①
某氮化铝样品中含有氧化铝杂质.已知氮化铝和NaOH溶液能反应,并产生氨气,其反应方程式为:AlN+NaOH+H2O→NaAlO2+NH3↑……②,
氧化铝也能与氢氧化钠溶液反应而全部溶解……③
(3)配平化学化学方程式①:___Al2O3(s)+ C(s)+ N2(g)→ AlN(s)+ CO(g)
(4)反应②中产生气体的检验方法为____________________________________________;
反应③的离子方程式___________________________________________________________。