��Ŀ����
����Ŀ����Ȼ������Ҫ�ɷּ���ȼ�����ɶ�����̼��Һ̬ˮ���Ȼ�ѧ����ʽ�ǣ�CH4(g) + 2O2(g) == CO2(g) + 2H2O��l�� ��H== ��889.6kJ/mol����ش��������⣺
��1����Ӧ�������ܺ�________������ڡ�����С�ڡ����ڡ��������������ܺ͡�
��2����1 mol������ȫȼ�����ɶ�����̼��ˮ��������ų�������___________���������������������889.6kJ��
��3����֪����ȼ������Һ̬ˮ���Ȼ�ѧ����ʽ�ǣ�2H2(g)+O2(g) ===2H2O��l�� ��H =��572kJ/mol ������ͬ�����ļ������������ȫȼ������Һ̬ˮ�����Ƚ϶����________��
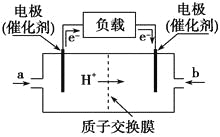
��4����ͼ��ʾ��װ������CH4 ��O2��KOH��Һ��ɵ�����ȼ�ϵ�ء�
�ٸõ�صĸ�����______(�a����b��)�缫���ü��ĵ缫��Ӧʽ��_____��
�ڵ�ع���һ��ʱ���������Һ��pH________(���������С�����䡱)��

���𰸡����� < ���� a CH4��10OH����8e��===CO32����7H2O ��С
��������
��1����֪CH4��g��+2O2��g��=CO2��g��+2H2O��l����H=��889.6kJ/mol����Ӧ�Ƿ��ȷ�Ӧ�����Է�Ӧ�������ܺʹ��������������ܺͣ��ʴ�Ϊ�����ڣ�
��2��ˮ����ת��ΪҺ̬ˮҪ�ų�����������1mol������ȫȼ�����ɶ�����̼��ˮ�������ų�������С��889.6kJ���ʴ�Ϊ������
��3����֪CH4��g��+2O2��g��=CO2��g��+2H2O��l����H=��889.6kJ/mol��2H2��g��+O2��g��=2H2O��H=��572kJ/mol����1g������ȫȼ�շų�������Ϊ![]() ��889.6kJ=55.6kJ��1g������ȫȼ�շų�������Ϊ
��889.6kJ=55.6kJ��1g������ȫȼ�շų�������Ϊ![]() ��572kJ=143kJ��������ͬ�����ļ������������ȫȼ������Һ̬ˮ�������ŵ������϶࣬�ʴ�Ϊ��������
��572kJ=143kJ��������ͬ�����ļ������������ȫȼ������Һ̬ˮ�������ŵ������϶࣬�ʴ�Ϊ��������
��4���ٸõ�صĸ�����CH4���缫aΪ����������������Ӧ���缫��ӦʽΪ��CH4+10OH����8e���TCO32��+7H2O���ʴ�Ϊ��a��CH4��10OH����8e��===CO32����7H2O��
���ܵĵ缫��ӦʽΪCH4+2OH��+2O2=CO32��+3H2O�����ܵĵ缫��Ӧʽ��֪�����������Ӳ��ϱ����ģ��ҷ�Ӧ������ˮ�������������ӵ�Ũ�ȼ�С��������Һ��pHֵ��С���ʴ�Ϊ����С��