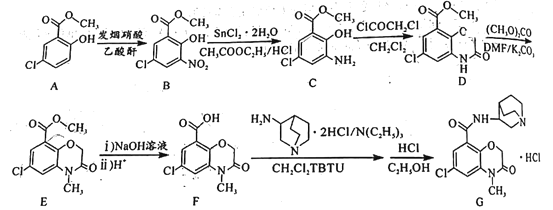
题目内容
【题目】二氯化二硫(S2Cl2)是一种无色液体,有刺激性、窒息性恶臭。人们使用它作橡胶的低温硫化剂和黏结剂。向熔融的硫中通入限量的氯气即可生成S2Cl2,进一步氯化得SCl2。
S2Cl2、SCl2、S的某些性质如下:

实验室可用如图所示装置制备少量S2Cl2。
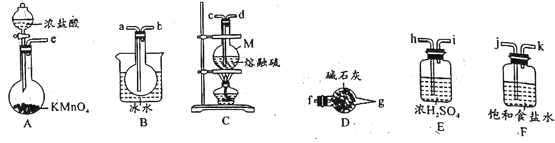
(1)仪器M的名称是__。
(2)实验室中用高锰酸钾与浓盐酸制取Cl2的化学方程式为__。
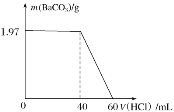
(3)欲得到较纯净的S2Cl2,上述仪器装置的连接顺序为e→__→f(按气体流出方向)。D装置中碱石灰的作用是_。
(4)S2Cl2粗品中可能混有的杂质是__(填化学式),从S2Cl2粗品中提纯S2Cl2的操作方法是__(填操作名称)。.
(5)若产物S2Cl2中混入少量水,则发生反应的化学方程式为__。
(6)对提纯后的产品进行测定:取mg产品,加入50mL水充分反应(SO2全部逸出),过滤,洗涤沉淀并将洗涤液与滤液合并,用100mL容量瓶定容,取20.00mL溶液与浓度为0.4000mol·L-1的硝酸银溶液反应,消耗硝酸银溶液20.00mL,则产品中氯元素的质量分数为__(用含有m的式子表示)。
【答案】圆底烧瓶 ![]() jkhicdab 吸收剩余的氯气,并防止空气中的水蒸气进入装置B使S2Cl2水解 Cl2、SCl2、S 分馏(或蒸馏)
jkhicdab 吸收剩余的氯气,并防止空气中的水蒸气进入装置B使S2Cl2水解 Cl2、SCl2、S 分馏(或蒸馏) ![]()
![]() 或
或![]()
【解析】
(1)根据装置图分析仪器M的名称;
(2)高锰酸钾与浓盐酸在常温下生成氯化钾、氯化锰、氯气和水;
(3)欲得到较纯净的S2Cl2,氯气先除杂、干燥,再与熔融的S反应,用冰水收集S2Cl2,最后用碱石灰收集多余氯气,注意导气管长进短出 ;
(4)根据S2Cl2、SCl2、S、Cl2的沸点较低分析;
(5)S2Cl2和水发生歧化反应生成SO2、S、HCl;
(6)滴定过程中反应的离子方程式是![]() 。
。
(1)根据装置图,仪器M的名称是圆底烧瓶;
(2)高锰酸钾与浓盐酸在常温下生成氯化钾、氯化锰、氯气和水,化学方程式为![]() ;
;
(3)欲得到较纯净的S2Cl2,氯气先除杂、干燥,再与熔融的S反应,用冰水收集S2Cl2,最后用碱石灰收集氯气;上述仪器装置的连接顺序为e→j → k →h →i →c→ d→a→b→f。S2Cl2易水解,所以D装置中碱石灰的作用是吸收剩余的氯气,并防止空气中的水蒸气进入装置B使S2Cl2水解;
(4)氯气和硫可能有剩余,均有可能混入产品中,氯气过量时,会生成SCl2,因此S2Cl2粗品中可能混有的杂质是SCl2、S、Cl2;根据S2Cl2、SCl2、S、Cl2的沸点不同,S2Cl2粗品中提纯S2Cl2的操作方法是蒸馏(或分馏);
(5)S2Cl2和水发生歧化反应生成SO2、S、HCl,根据得失电子守恒配平反应式为![]() ;
;
(6)滴定过程中反应的离子方程式是![]() ,则20.00mL溶液中氯离子的物质的量是0.4mol·L-1×0.02L=0.008mol,产品中氯元素的质量分数为
,则20.00mL溶液中氯离子的物质的量是0.4mol·L-1×0.02L=0.008mol,产品中氯元素的质量分数为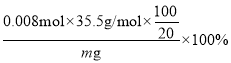 =
=![]() ;
;

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案